Legame covalente

Multi tool use
.mw-parser-output .avviso .mbox-text-div>div,.mw-parser-output .avviso .mbox-text-full-div>div{font-size:90%}.mw-parser-output .avviso .mbox-image div{width:52px}.mw-parser-output .avviso .mbox-text-full-div .hide-when-compact{display:block}
Questa voce o sezione sull'argomento processi chimici non cita le fonti necessarie o quelle presenti sono insufficienti. |

Legame covalente singolo tra due atomi di cloro.
In chimica, un legame covalente è un legame chimico in cui due atomi mettono in comune delle coppie di elettroni.
Ciò avviene perché gli atomi tendono al minor dispendio energetico possibile ottenibile con la stabilità della loro configurazione elettronica (ad esempio l'ottetto). Gli orbitali atomici contenenti gli elettroni spaiati si sovrappongono in orbitali molecolari, dando luogo ad una molecola.
Indice
1 Tipologia di legami covalenti
1.1 Legame covalente puro
1.2 Legame covalente polare
1.3 Legame di coordinazione o dativo
2 Legame covalente e legame ionico
3 Valenza dei legami covalenti
4 Legami covalenti polari e polarità della molecola
5 Note
6 Bibliografia
7 Voci correlate
8 Collegamenti esterni
Tipologia di legami covalenti |
Legame covalente puro |
Il legame covalente è il risultato di un'interazione elettrostatica che coinvolge gli atomi. Questa interazione elettrostatica si ha tra i nuclei degli atomi (carichi positivamente) e gli elettroni condivisi (carichi negativamente).
Gli elettroni condivisi tramite il legame covalente sono delocalizzati intorno ai due atomi, formando una cosiddetta "nube elettronica", cioè uno spazio in cui esiste la possibilità di trovare gli elettroni condivisi.
Si parla di legame covalente omopolare (o puro o apolare) se la nube elettronica è distribuita simmetricamente (cioè il legame risulta non polarizzato). In questo caso il doppietto elettronico è condiviso in egual misura tra i due atomi coinvolti, cioè gli elettroni condivisi trascorrono lo stesso tempo in prossimità di ciascuno dei due atomi, non avendo una particolare preferenza per uno dei due atomi.

Un legame covalente omopolare si ha quando la differenza di elettronegatività tra due atomi è minore o uguale a 0,4.
Un esempio di molecola contenente un legame covalente puro è la molecola di idrogeno (H2), ottenuta dalla combinazione di due atomi di idrogeno:
H· + ·H → H:H
In generale, si ha legame covalente puro quando gli atomi coinvolti nel legame appartengono allo stesso elemento chimico. In questo caso infatti la differenza di elettronegatività tra i due atomi è nulla.
Legame covalente polare |
Nel caso in cui si abbia una moderata differenza di elettronegatività tra i due atomi coinvolti nel legame covalente (per cui si è in presenza di un dipolo molecolare permanente), gli elettroni condivisi risultano maggiormente attratti dall'atomo più elettronegativo, il legame risulterà quindi polarizzato elettricamente.
Si parla in questo caso di legame covalente eteropolare (o polare).
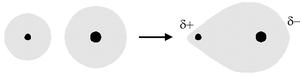
Un legame covalente polare si instaura quando avviene una sovrapposizione degli orbitali atomici di due atomi con una differenza di elettronegatività minore o uguale a 1,7[1] e maggiore di 0,4.
Ad esempio la differenza di elettronegatività tra l'idrogeno (2,20) e il cloro (3,16) è pari a 0,96 (= 3,16 - 2,20), per cui il legame tra idrogeno e cloro nella molecola di acido cloridrico (H-Cl) è di tipo covalente eteropolare.
Legame di coordinazione o dativo |
Quando entrambi gli elettroni coinvolti nel legame provengono da uno solo dei due atomi, mentre l'altro fornisce un orbitale vuoto in cui allocarli, si parla di legame di coordinazione.
Legame covalente e legame ionico |
Quando i doppietti elettronici sono fortemente vincolati all'elemento più elettronegativo, non si parla più di legame covalente, bensì di legame ionico; per convenzione, si parla di legame ionico se la differenza di elettronegatività tra gli atomi coinvolti nel legame è maggiore di 1,9, mentre si parla di legame covalente quando la differenza di elettronegatività tra gli atomi coinvolti nel legame è minore o uguale a 1,9.
Valenza dei legami covalenti |
A seconda del numero di elettroni condivisi, si possono avere i seguenti casi:
- legame covalente singolo (o legame monovalente o legame semplice): viene condivisa una sola coppia di elettroni; nelle formule chimiche tale legame si rappresenta con un singolo trattino (-) posizionato tra i due atomi coinvolti nel legame (ad esempio: H-H);
- legame covalente doppio (o legame bivalente): vengono condivise due coppie di elettroni; nelle formule chimiche tale legame si rappresenta con un doppio trattino (=) posizionato tra i due atomi coinvolti nel legame (ad esempio: O=O);
- legame covalente triplo (o legame trivalente): vengono condivise tre coppie di elettroni; nelle formule chimiche tale legame si rappresenta con un triplo trattino (≡) posizionato tra i due atomi coinvolti nel legame (ad esempio: H-C≡C-H).
Esistono anche legami tetravalenti (ampiamente studiati in chimica inorganica) e nel 2005 è stata dimostrata l'esistenza di legami quintupli in molecole stabili.[2]
Legami covalenti polari e polarità della molecola |
Le molecole che contengono legami covalenti polari possono presentare una certa polarità causata da una distribuzione non simmetrica delle cariche.
Ad esempio, la molecola dell'acqua presenta due legami covalenti polari tra l'ossigeno e ognuno dei due atomi di idrogeno. L'elettronegatività dell'ossigeno (3,52 circa) prevale su quella dell'idrogeno (2,11 circa), attirando verso di sé gli elettroni dei due atomi di idrogeno e polarizzando ciascun legame. La molecola dell'acqua presenta un angolo di legame di 104°45' e costituisce nel suo complesso un dipolo elettrico che ha nell'atomo di ossigeno la sua estremità negativa e nei due atomi di idrogeno la sua estremità positiva.
Più semplice è il caso della molecola dell'acido cloridrico (H-Cl): in questo caso la maggiore elettronegatività del cloro fa sì che la molecola sia un dipolo che ha nell'atomo di cloro la sua estremità negativa e nell'atomo di idrogeno la sua estremità positiva.
In altri casi, ai legami covalenti polari può essere associata una distribuzione simmetrica delle cariche, per cui la molecola risulta apolare.
Ad esempio, gli atomi della molecola del diossido di carbonio sono disposti lungo una retta (O=C=O). Pur essendo ogni doppio legame C=O polare, la simmetria della molecola annulla le due polarità uguali in intensità ma opposte in direzione. Quindi la molecola di diossido di carbonio risulta complessivamente apolare.
Note |
^ Depaoli, Chimica generale e inorganica, p.84
^ Synthesis of a Stable Compound with Fivefold Bonding Between Two Chromium(I) Centers Tailuan Nguyen, Andrew D. Sutton, Marcin Brynda, James C. Fettinger, Gary J. Long, and Philip P. Power Pubblicato online il 22 settembre 2005; 10.1126/Science.1116789 Support info
Bibliografia |
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 6-7, ISBN 88-08-09414-6.
- Alberto Costanzo, Esercitazioni di chimica. Compendio teorico ed esercizi di chimica per ingegneria, 2ª ed., Esculapio, 2010, ISBN 978-88-7488-377-6.
Voci correlate |
- Legame chimico
- Legame σ
- Legame π
- Legame δ
- Legame di coordinazione
- Legame ionico
- Polarità delle molecole
- Risonanza (chimica)
Collegamenti esterni |
- (EN) IUPAC Gold Book, "covalent bond", su goldbook.iupac.org.
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | GND (DE) 4143323-3 |
|---|
cWgfnAnQfXHMqf wRsLpG0un iabnG0PyHYTdET 3Aw egm7Rhw1U5,iVR1UlN mLVYn