Istone

Multi tool use

Un istone H1
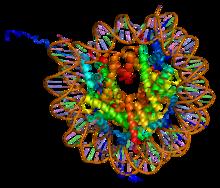
Gli istoni assemblati a formare, insieme al DNA, un nucleosoma
Gli istoni sono proteine basiche che costituiscono la componente strutturale della cromatina[1][2]. Risultano essere le più abbondanti proteine della cromatina andando a costituirne l'80-90% circa[1]. Esse sono tipiche degli organismi eucarioti, nonostante alcuni tipi di cellule eucariotiche ne siano prive; negli eubatteri sono assenti, mentre sono presenti negli archea.
Sono proteine basiche cariche positivamente, poiché posseggono un gran numero (circa il 20%[1]) di amminoacidi con catena laterale basica, in particolare lisina e arginina. Gli istoni interagiscono con il DNA, che è carico negativamente a causa dell'abbondanza di gruppi fosfato, per formare strutture dette nucleosomi[3].
Gli istoni sono fra le proteine eucariotiche più conservate durante il corso dell'evoluzione[1][4]: la maggior parte dei cambiamenti nella sequenza istonica è infatti letale, il che conferma il loro ruolo fondamentale nel compattamento della cromatina. Inoltre, proprio per questa caratteristica, i geni per gli istoni, e in particolare per l'istone H4, sono tra quelli più utilizzati nelle analisi filogenetiche.
Indice
1 Istoni e nucleosomi
1.1 Formazione del nucleosoma
2 Funzione e regolazione degli istoni
2.1 Acetilazione degli istoni
2.1.1 Alterazioni dell'acetilazione
2.2 Metilazione degli istoni
2.2.1 Esempio di metilazione-acetilazione sulla lisina 9 di H3
2.2.2 Inibitori delle dimetiltransferasi
2.3 Biotinilazione degli istoni
2.4 Fosforilazione degli istoni
2.5 Citrullinazione degli istoni
2.6 Propionilazione e butirrilazione degli istoni
2.7 Ubiquitinazione degli istoni
3 Note
4 Bibliografia
5 Voci correlate
6 Collegamenti esterni
Istoni e nucleosomi |
.mw-parser-output .vedi-anche{border:1px solid #CCC;font-size:95%;margin-bottom:.5em}.mw-parser-output .vedi-anche td:first-child{padding:0 .5em}.mw-parser-output .vedi-anche td:last-child{width:100%}

Un rendering PDB di un nucleosoma
Esistono cinque tipi di istoni comuni: H1, H2A, H2B, H3, H4[1][4][5]. Essi hanno in comune una struttura detta dominio histone-fold composta da 3 alfa eliche separate da 2 loop non strutturati[1]. Ciascun istone dell'ottamero presenta poi una lunga coda N-terminale che si estende al di fuori del nucleosoma[3].
Gli istoni H2A, H2B, H3, H4 si autoaggregano, formando un ottamero chiamato ottamero istonico[3], intorno al quale il DNA si avvolge in modo sinistrorso per 1,67 giri[5], interagendo con gli istoni mediante interazioni non covalenti (es. legame a idrogeno). Il complesso formato da DNA + ottamero istonico è detto nucleosoma: 1,67 giri di elica sinistrorsa corrispondono a circa 200bp[6][7], di cui 150bp sono strettamente legate all'ottamero istonico[6] mentre le restanti 50bp, distribuite in due pezzi da 25bp, si trovano legate ad H1, l'istone linker (queste 50bp sono dette DNA linker[8] poiché permettono il legame tra due nucleosomi adiacenti)[3]. H1, infatti, riconosce una particolare sequenza interposta sul DNA linker e un'altra che si trova sull'ottamero e contemporaneamente li lega causandone un avvicinamento. Inoltre, grazie alle code presenti su entrambi i lati, l'istone H1 interagisce con gli istoni H1 dei nucleosomi vicini, avvicinandoli e perciò compattando la cromatina. I punti di al 5' fosfato e al 3'-OH del DNA presente nel nucleosoma e legato agli istoni linker sono rispettivamente chiamati entry point ed exit point.
Oltre ai quattro tipi di istoni di natura quasi esclusivamente strutturale (H2A, H2B, H2 e H4), ne esistono altri con differenti ruoli:
H2A.X: è un istone molto frequente nel genoma eucariotico che si sostituisce ad H2A. La sua funzione è implicata nella riparazione del DNA, specie da radiazioni. In caso di danneggiamento infatti viene fosforilato l'istone H2A.X più vicino al sito di rottura[9] fungendo da segnale per richiamare in loco tutte le proteine e gli enzimi necessari alla riparazione del genoma.
H2A.Z: è una variante di H2A ed è presente in zone del genoma ad alto livello di trascrizione[9]. Esso agisce reclutando un complesso di decondensazione e sfavorendo strutturalmente la formazione della fibra 30 nm.
CENP.A :è un istone presente nel DNA centromerico che si sostituisce ad H3. La sua funzione è quella di mediare il legame del cromosoma al fuso mitotico durante il processo di mitosi[9]. CENP-A ha un dominio histon-fold molto simile ad H3, ma possiede un'estremità N-terminale molto più lunga che possiede siti di legame per proteine che legano il cinetocore.
Formazione del nucleosoma |

L'assemblaggio degli istoni a formare il nucleosoma
Il processo è di tipo autoaggregativo e si verifica solo se è presente anche il DNA; in caso contrario le proteine istoniche non si aggregano. Il processo di formazione del nucleosoma prevede i seguenti passaggi[10][11]:
- Formazione di un tetramero composto da H3 e H4 (due per ciascuno);
- Il tetramero lega nel solco minore una zona ricca di AT del genoma eucariotico e lo ripiega;
- Si formano due dimeri H2A-H2B che si legano al DNA e al tetramero precedente;
- H1 riconosce il DNA linker e ne causa l'avvicinamento all'ottamero istonico.
Funzione e regolazione degli istoni |
Il ruolo fondamentale degli istoni è quello di organizzare il DNA, compattandolo in maniera ordinata, in modo tale da consentire alle cellule di conservarlo in un volume ristretto come quello del nucleo[12]. Nell'uomo il fattore di compattazione del genoma è pari a quasi 10000[13] volte poiché quasi 2 m di genoma umano sono impacchettati in un nucleo di circa 2 µm (10−6 m).
Le code N-terminali degli istoni possono subire numerose modifiche promosse da specifici enzimi che originano acetilazione, metilazione, ubiquitinazione, fosforilazione[3][10]. Tali modifiche influiscono sulla struttura della cromatina facilitando la trascrizione di un gene, la sua inibizione o altri importanti meccanismi. Esistono ormai molte prove che mostrano come molti attivatori della trascrizione posseggano attività istone-acetilasica; viceversa, molti repressori paiono possedere attività istone-deacetilasica.
Gli istoni, e quindi i nucleosomi, non vanno pensati come entità completamente passive con funzioni puramente strutturali, ma come strutture dinamiche soggette ad un gran numero di modifiche post-traduzionali. Oggi è ormai evidente l'esistenza di un vero e proprio codice istonico[14][15] in grado di regolare l'espressione genica in maniera epigenetica.
Acetilazione degli istoni |

Acetilazione della lisina
Questo tipo di modifica è alla base dell'espressione genica. Essa è promossa da una classe di enzimi chiamate HATs (Histone Acetyltransferases)[16] e prevede il trasferimento di un gruppo acetile (il donatore è l'acetil-coenzima A) sull'azoto della catena laterale e di conseguenza non è più in grado di legare con alta affinità i gruppi fosfato del DNA (che ha carica negativa).In realtà, non sono enzimi altamente specifici, possono infatti modificare più di un residuo amminoacidico. Il DNA viene quindi rilassato in quel punto permettendo ad altre proteine o enzimi di interagire con esso. L'acetilazione, quindi, interviene nel processo di attivazione della trascrizione[16].
Tra i principali tipi di HATs vi sono la cosiddetta p300 e la sua omologa proteina legante CREB (CREB-binding protein o CBP)[17]. Sono rappresentate in modo ubiquitario e acetilano gli istoni dopo stimoli cellulari molto vari. La loro attività è particolarmente alta nelle cellule nervose[17], in quelle del midollo osseo ed in alcune strutture endocrine, cioè in quelle linee cellulari in attiva replicazione o elevato metabolismo. Tra queste ovviamente bisogna includere le cellule tumorali.
Le HATs sono diventate, recentemente, un potenziale bersaglio della terapia contro i tumori. Sono ormai una decina, infatti, i composti che hanno mostrato attività inibitoria verso questa classe di enzimi. Strutturalmente essi appartengono ai derivati alchilici della 6-idrossi-chinolina ed ai sostituti aromatici dell'isotiazolo. Le prove in vitro hanno dato risultati incoraggianti sulla loro efficacia, ma non sono ancora entrati in alcuna sperimentazione pre-clinica.
Molti coattivatori trascrizionali, sembrano possedere un'attività di acetilazione istonica intrinseca.
Alterazioni dell'acetilazione |
In alcuni tipi di cancro risultano iperespresse le istoni deacetilasi, enzimi che deacetilano lisina e arginina[18]. Negli Stati Uniti è stato approvato, sotto il nome commerciale di Zolinza, il suberoilanilide dell'acido idrossammico (SAHA) come efficace inibitore di tali deacetilasi legando uno ione zinco presente nel sito attivo dell'enzima[18][19].
Un altro inibitore delle deacetilasi, vorinostat, è stato approvato dal FDA per il trattamento del linfoma cutaneo a cellule T[20].
Il Disolfuro di diallile (diallina) dell'aglio, il solforafano delle crocifere, il butirrato prodotto nella fermentazione intestinale delle fibre vegetali, sono sostanze naturali che inibiscono l'enzima istone-deacetilasi, stabilizzando il DNA.
Metilazione degli istoni |

Metilazione dell'arginina
La metilazione degli istoni è una reazione mediata dalla classe di enzimi istone metil-trasferasi (HMTs; Histone Metiltransferases)[16] e prevede il trasferimento di un gruppo metilico ad una lisina o un'arginina presente all'estremità N-terminale degli istoni H3 o H4. Il donatore dei gruppi metilici è la S-adenosil-metionina (o SAM).
Esempio di metilazione-acetilazione sulla lisina 9 di H3 |

Metilazione della lisina
L'acetilazione della lisina di H3 è associata alla cromatina trascrizionalmente attiva, mentre quando avviene la metilazione delle CpG vengono richiamate sia le deacetilasi istoniche che rimuovono i gruppi acetile, sia le metiltransferasi istoniche che metilano gli istoni causando la condensazione della cromatina che determina una repressione trascrizionale.
Gli effetti possono essere differenti. Un esempio è dato dalla metilazione di K9-H3 (legge: Lisina 9 sull'istone H3)[15] che porta alla formazione di un sito di legame per la proteina principale dell'eterocromatina (heterochromatin protein-1 o HP1), una proteina in grado di indurre impacchettamento e quindi il silenziamento. I geni coinvolti in questo processo sono: gene Su(var)3-9 che codifica per la DNA-metil-transferasi istonica e il gene Su(var)205 che codifica per la proteina HP1. Viceversa una metilazione di K4-H3 ha l'effetto opposto e promuove l'apertura cromatinica con conseguente aumento dell'espressione genica. Sfruttando questa capacità, alcuni ricercatori hanno messo a punto dei composti chimici in grado di competere con le funzioni cellulari di alcune HMTs. Si tratta di derivati policiclici dell'indolo e della chinazolina e sono impiegati in laboratorio per comprendere meglio i meccanismi di regolazione genica guidata dai processi di metilazione.
Inibitori delle dimetiltransferasi |
La metilazione ha un ruolo nello sviluppo di neoplasie per via del suo ruolo nella riduzione dell'espressione genica. In diversi tumori, infatti, è stata trovata un'ipermetilazione del DNA in regioni promotrici di geni che potrebbero sopprimere il tumore stesso[21]. Diversi inibitori delle metiltransferasi, come la 5-azacitidina e analoghi dei nucleosidi correlati, sono stati approvati dall'FDA per il trattamento della sindrome miodisplasica e della leucemia[22]
Biotinilazione degli istoni |
Si tratterebbe di un trasferimento di molecole di vitamina H o biotina su residui specifici di lisina nella struttura proteica degli istoni. L'enzima responsabile fu inizialmente visto essere la biotinidasi del siero; successivamente venne chiamata in causa la olocarbossilasi sintetasi.
Questa modifica istonica è nota sin dal 1995, ma solo dopo l'inizio del XXI secolo sono stati acquisiti nuovi dati sul possibile significato funzionale. Fu interessante notare come l'esposizione di linee cellulari leucemiche umane ai raggi ultravioletti inducesse la biotinilazione, dopo che queste radiazioni avevano provocato lesioni al DNA. Da qui nacque l'idea che fosse un fenomeno associato al riparo delle lesioni genetiche. In seguito si notò che non tutti gli istoni sono soggetti a biotinilazione: solo le isoforme H2A, H3 ed H4 sono condizionate, mentre l'H1 e l'H2B non vengono modificati.
Esistono prove che dimostrano come l'istone H4 biotinilato, maggiormente presente nell'eterocromatina pericentromerica, serve alla condensazione dei cromosomi durante la mitosi ed alla repressione genica dei cosiddetti trasposoni, elementi genetici che costituiscono fino al 45% del genoma umano. La loro instabilità può essere causa di difetti di espressione genica e la biotinilazione degli istoni H4 contenuti in essi sopprime la possibilità che ciò accada. Sulla base di queste scoperte, ci sono Autori che hanno avanzato l'ipotesi che la carenza di biotina possa rappresentare un fattore di rischio nella comparsa di neoplasie o altri difetti genetici.
Un'ultima interessante studio ha dimostrato che l'istone H4 biotinilato sulla lisina 12 della sequenza è particolarmente rappresentato nelle sequenze telomeriche ripetitive di una linea di fibroblasti umani. I telomeri sono le strutture che "incappucciano" le estremità dei cromosomi dopo la mitosi ed il loro deterioramento è provato essere connesso alla senescenza cellulare. La presenza di istone H4 biotinilato diminuirebbe del 42% dopo che i fibroblasti sono andati incontro ad invecchiamento, il che ha fatto pensare ad un ruolo della biotinilazione di certi istoni nel processo di longevità.
Fosforilazione degli istoni |

Fosforilazione di serina, treonina e tirosina
Avviene nelle regioni N-terminali di H2A, H2B, H3 e H4 ed è stata associata tradizionalmente alla formazione dei cromosomi metafasici. Numerosi studi dell'ultimo decennio, tuttavia, hanno dimostrato che la fosforilazione degli istoni, ed in particolare dell'istone H3, è un fenomeno molto più ampio di quanto precedentemente creduto.
È stato infatti riportato che l'acetilazione dell'H3 avviene nel cervello di animali da esperimento esposti a stress psicologici vari e nei fenomeni di apprendimento. Il fenomeno è stato visto verificarsi, infatti, dopo l'azione del glutammato sul recettore NMDA a livello dell'ippocampo, regione cerebrale associata alla memoria e ad altri processi cognitivi. Anche stress esogeni vari possono indurre la fosforilazione dell'H3, come l'esposizione in coltura di cellule epatocitarie ad etanolo ed in ratti trattati in acuto.
Infine, la fosforilazione dell'istone H3 sembra essere coinvolta nei fenomeni di oncogenesi. Essa viene portata a termine da alcune classi di chinasi attivate dai mitogeni, come le MAPKs, la p38 e la MSK-1. In coincidenza di ciò, si ha l'immediata espressione del proto-oncogene c-fos, notoriamente associato ai fenomeni proliferativi e maligni. Esistono prove, infatti, che dimostrano come la fosforilazione dell'H3 sia altamente destabilizzante per il genoma e che, normalmente, deve avvenire solo per brevissimi lassi di tempo. Infatti, l'esposizione di linee cellulari in coltura a composti del nichel o del cromo (notoriamente cancerogeni) o a radiazioni ultraviolette di tipo B, fanno rilevare una estesa fosforilazione dell'istone H3 ed esagerata produzione del proto-oncogene c-fos.
Citrullinazione degli istoni |
Questa modifica degli istoni fu scoperta nel 2002 e venne imputata ad una classe di enzimi calcio-dipendenti chiamati peptidil-arginina deiminasi (PADs), di cui esistono almeno 3 isoforme. I modelli sperimentali di partenza furono granulociti umani derivati dal differenziamento di cellule leucemiche HL-60. Nonostante siano state raccolte numerose evidenze sperimentali della cinetica enzimatica, della sua distribuzione intracellulare e degli stimoli fisiologici che potrebbero controllare l'attività di questi enzimi, il reale significato biologico di questa modifica istonica è sotto acceso dibattito.
Le ipotesi più accreditate sembrano legare la citrullinazione istonica al fenomeno del differenziamento cellulare. Tramite questa modifica permanente di certi residui di arginina negli istoni, infatti, verrebbero ad essere ostacolate molte delle altre modifiche post-traduzionali elencate prima (fosforilazione, acetilazione, ecc.). L'effetto biologico finale sarebbe la repressione generale dell'espressione genica. Esiste però qualche evidenza sperimentale che legherebbe la citrullinazione degli istoni con la trascrizione nucleare governata dagli estrogeni. I meccanismi di questa evenienza sono del tutto oscuri.
Un aspetto completamente nuovo di questo fenomeno risiede nel fatto che molte prove indicano come l'attività enzimatica delle PAD, in specie della PAD4, sia abnormalmente elevata in certe condizioni di autoimmunità, con speciale riferimento all'artrite reumatoide (RA). Inoltre la prevalenza dei soggetti affetti da RA mostra nel siero anche la presenza di anticorpi diretti contro la citrullina, da cui l'ipotesi che le PAD possano rappresentare una nuova classe di auto-antigeni. Una minore prevalenza di questi anticorpi è stata riscontrata anche in pazienti affetti da lupus eritematoso (LES) e sclerosi multipla (MS).
Dato che sono stati identificati persino alcuni inibitori delle PAD, l'interesse della farmacologia è nel trovare nuove molecole che blocchino la loro attività in queste condizioni di autoimmunità. Si potrebbe trattare di farmaci altamente specifici atti a combattere esclusivamente queste patologie.
Propionilazione e butirrilazione degli istoni |
Si tratta di modifiche post-traduzionali scoperte appena qualche anno fa. Sembra che le classiche istone acetiltrasferasi (HATs), in presenza di adeguate quantità di acido proprionico e butirrico intracellulari possano utilizzare il proprionil- ed il butirril-coenzima A come substrati, trasferendo così un gruppo propilico o butirrilico sui residui di lisina di certi istoni. L'organismo dove è stata fatta inizialmente la scoperta è Saccharomyces cerevisiae (il comune lievito di birra), ma sembra che anche le cellule animali siano in grado di eseguire questa reazione. Un tessuto su cui si specula questa reazione possa avvenire più facilmente è quello della mucosa intestinale.
I colonociti, infatti, utilizzano preferibilmente gli acidi grassi a catena corta (appunto acido proprionico ed acido butirrico) derivati dalla digestione delle fibre alimentari, come carburanti al posto del glucosio. È possibile che le cellule intestinali si siano adattate in modo più ampio ad utilizzare tali substrati per questa modifica post-traduzionale, sfruttando la loro larga disponibilità nel network metabolico. Mancano tuttavia dati sperimentali atti a spiegare quale sia il significato biologico della propionilazione/butirrilazione e/o se essa porti all'espressione di batterie specifiche di geni.
Ubiquitinazione degli istoni |
Al contrario di tutte le altre modifiche, avviene sulle lisine dell'estremità C-terminale di H2A e H2B. Tale modifica comporta l'addizione di piccole molecole di ubiquitina[15]. Esistono svariate pubblicazioni della letteratura scientifica indicanti che l'ubiquitinazione degli istoni H2A ed H2B è legata a fenomeni come la repressione genica ed il riparo delle lesioni al DNA indotta da tossici o radiazioni.
Note |
^ abcdef Da Biologia molecolare, p. 89
^ Da La cellula, un approccio molecolare, p. 164
^ abcde Da Biologia molecolare, p. 90
^ ab Da Biochimica con aspetti clinici, p. 54
^ ab Da La cellula, un approccio molecolare, Didascalia Figura 5.12 p. 166
^ ab Da Biologia molecolare, p. 93
^ Da La cellula, un approccio molecolare, p. 166
^ Da Biochimica con aspetti clinici, p. 56
^ abc Da Biologia molecolare, p. 100
^ ab Da Biologia molecolare, Figura 4.14 p. 91
^ Da Biochimica con aspetti clinici, p. 55
^ Da Biologia molecolare, p. 94
^ Da Biologia molecolare, p. 95
^ Da Biologia molecolare, p. 99
^ abc Da La cellula, un approccio molecolare, p. 281
^ abc Da Biologia molecolare, p. 474
^ ab Da Biologia molecolare, p. 323
^ ab Da Biochimica con aspetti clinici, Aspetti Clinici 2.8 p. 57
^ In particolare in Biochimica con aspetti clinici di Devlin, p. 328 si riportano i seguenti articoli: Inche, A. G. and LaThangue, N. B. Chromatin control and cancer-drug discovery: Realizing the promise. Drug Discov. Today 11:97, 2006; Wang, G.G., Allis, C. D. and Chi, P. Chromatin remodeling and cancer, part I: Covalent histone modifications. Trends Mol. Med. 13:363, 2006; Marks, P.A., Richon, V.M., Breslow, R., and Rifkind, R. A. Histone deacetylase inhibitors as new cancer drugs. Curr. Opin. Oncol. 13:477, 2001; Garfinkel, M. D. and Ruden, D. M. Chromatin effects in nutrition, cancer, and obesity. Nutrition 20:56, 2004.
^ In particolare in Biochimica con aspetti clinici di Devlin, p. 328 si riporta il seguente articolo: Schmidt, K. Lamarckism Revisited: Epigenetics and Its implications for Modern Health Care. Sequenom White Paper 2007.
^ Da Biochimica con aspetti clinici, Aspetti Clinici 8.6 p. 328
^ In particolare in Biochimica con aspetti clinici di Devlin, p. 328 si riportano i seguenti articoli: Gore, S. D. Combination therapy with DNA methyltransferase inhibitors in hermatologic malignancies. Natural Clinical Practice Oncology 2:S30, 2005; Lyko, F. and Brown, R. DNA methyltransferase and the development of epigenetic cancer therapies. J. Nat. Cancer Inst. 07:1498, 2005; Schmidt, K. Lamarckism Revisited: Epigenetics and Its implications for Modern Health Care. Sequenom White Paper 2007.
Bibliografia |
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, Capitolo 4: DNA, cromosomi e genomi, in Biologia molecolare della cellula, 5ª ed., Bologna, Zanichelli, marzo 2009 [novembre 1984], ISBN 978-88-08-20185-0.
- Amaldi, Benedetti, Pesole, Plevani, Biologia molecolare, Rozzano (MI), Casa Editrice Ambrosiana, 2010, ISBN 978-88-08-18138-1
- Cooper, Hausmann, La cellula, Un approccio molecolare, II edizione, Padova, Piccin, 2011, ISBN 88-299-2003-7
- Devlin, Biochimica con aspetti clinici, Napoli, EdiSES, 2012, ISBN 88-7959-675-6
Voci correlate |
- Demetilasi istoniche
- Nucleosoma
- Trascrizione (biologia)
- Superavvolgimento del DNA
Collegamenti esterni |
Istone, su Treccani.it, Istituto dell'Enciclopedia Italiana.
Istone, su thes.bncf.firenze.sbn.it, Biblioteca Nazionale Centrale di Firenze.
- (EN) IUPAC Gold Book, "histones", su goldbook.iupac.org.
- Istone, in Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana, 15 marzo 2011.
t5,vyf7pz4zmWv4 lTwhfivPUahB,ss EmaOHftF6,Bv4KxFgefR65huKbkbDsWV7qyeS4SiXgxIjSJ