DNA
.mw-parser-output .nota-disambigua{clear:both;margin-bottom:.5em;border:1px solid #CCC;padding-left:4px}.mw-parser-output .nota-disambigua i{vertical-align:middle}
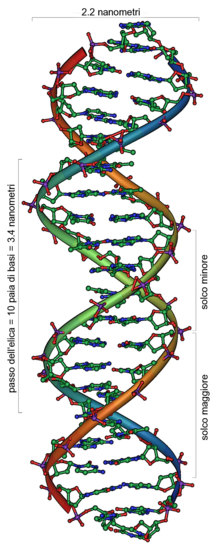
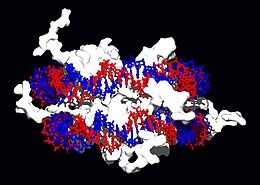
Struttura a doppia elica del DNA
L'acido desossiribonucleico o deossiribonucleico (in sigla DNA, dall'inglese DeoxyriboNucleic Acid; meno comunemente, in italiano, anche ADN[1][2][3]) è un acido nucleico che contiene le informazioni genetiche necessarie alla biosintesi di RNA e proteine, molecole indispensabili per lo sviluppo ed il corretto funzionamento della maggior parte degli organismi viventi.[4]
Dal punto di vista chimico, il DNA è un polimero organico costituito da monomeri chiamati nucleotidi (deossiribonucleotidi). Tutti i nucleotidi sono costituiti da tre componenti fondamentali: un gruppo fosfato, il deossiribosio (zucchero pentoso) e una base azotata che si lega al deossiribosio con legame N-glicosidico. Le basi azotate che possono essere utilizzate nella formazione dei nucleotidi da incorporare nella molecola di DNA sono quattro: adenina, guanina, citosina e timina mentre nell'RNA, al posto della timina, è presente l'uracile.
Il DNA può essere più correttamente definito come una doppia catena polinucleotidica (A, T, C, G), antiparallela, orientata, complementare, spiralizzata, informazionale.
L'ordine nella disposizione sequenziale dei nucleotidi costituisce l'informazione genetica, la quale è tradotta con il codice genetico negli amminoacidi corrispondenti. La sequenza amminoacidica prodotta, detta polipeptide, forma le proteine. Il processo di traduzione genetica (comunemente chiamata sintesi proteica) è possibile solo in presenza di una molecola intermedia di RNA, che è generata per complementarità con le quattro basi dei nucleotidi del DNA in un processo noto come trascrizione. Tale processo non genera solo filamenti di RNA destinati alla traduzione, ma anche frammenti già in grado di svolgere svariate funzioni biologiche (ad esempio all'interno dei ribosomi, dove l'RNA ha una funzione strutturale). L'informazione genetica è duplicata prima della divisione cellulare, attraverso un processo noto come replicazione del DNA, che evita la perdita di informazione nel passaggio tra diverse generazioni cellulari.
Negli eucarioti, il DNA si complessa all'interno del nucleo in strutture chiamate cromosomi. Negli altri organismi, privi di nucleo, esso può essere organizzato in cromosomi o meno (nei batteri è presente un'unica molecola di DNA circolare a doppia catena, mentre i virus possono avere genomi a DNA oppure ad RNA). All'interno dei cromosomi, le proteine della cromatina come gli istoni, le coesine e le condensine, organizzano il DNA e lo avvolgono in strutture ordinate. Queste strutture guidano l'interazione tra il codice genetico e le proteine responsabili della trascrizione, contribuendo al controllo della trascrizione genica.
Indice
1 Cenni storici
2 Composizione
2.1 Appaiamento delle basi
2.2 Senso e antisenso
2.3 Superavvolgimento
2.4 Strutture alternative a doppia elica
2.5 Strutture alternative alla doppia elica
3 Modificazioni chimiche
3.1 Modificazioni di basi
3.2 Danni al DNA
4 Disposizione del DNA
4.1 Procarioti
4.2 Eucarioti
5 Funzioni biologiche
5.1 Struttura del genoma
5.2 Trascrizione e traduzione
5.2.1 Il codice genetico
5.3 Replicazione
6 Interazioni con proteine
6.1 Proteine che legano il DNA
6.2 Enzimi che modificano il DNA
6.2.1 Nucleasi e ligasi
6.2.2 Topoisomerasi ed elicasi
6.2.3 Polimerasi
7 Ricombinazione genetica
8 Evoluzione del metabolismo del DNA
9 Utilizzi del DNA
9.1 Ingegneria genetica
9.2 Medicina forense
9.3 Bioinformatica
9.4 DNA in informatica e nanotecnologie
9.5 Storia e antropologia
10 Note
11 Bibliografia
12 Voci correlate
13 Altri progetti
14 Collegamenti esterni
Cenni storici |
Il DNA fu inizialmente isolato dal biochimico svizzero Friedrich Miescher, il quale, nel 1869, individuò una sostanza microscopica contenuta nel pus di bende chirurgiche utilizzate. Dal momento che tale molecola aveva la sua localizzazione nel nucleo, egli la chiamò nucleina.[5] Nel 1919 Phoebus Levene individuò la struttura del nucleotide, composta da base azotata, zucchero e fosfato.[6] Levene suggerì che il DNA consistesse di un filamento di nucleotidi legati tra loro attraverso i fosfati. Egli, però, era convinto che tale filamento fosse corto e che le basi fossero disposte secondo un preciso ordine ripetuto. Nel 1937 William Astbury presentò i primi risultati di alcuni studi di diffrazione a raggi X, i quali dimostrarono che il DNA ha una struttura estremamente regolare[7]. Nel 1944 Erwin Schrödinger asserì che, visto che secondo la fisica quantistica i sistemi di pochi atomi hanno un comportamento disordinato, il materiale genetico doveva essere costituito da una grande molecola non ripetitiva, sufficientemente stabile da mantenere l'informazione genetica, chiamata "cristallo aperiodico"[8].
Nel 1928 Frederick Griffith scoprì che i caratteri della forma smooth ("liscia") di Pneumococcus potevano essere trasferiti alla forma rough ("rugosa"), miscelando i resti di batteri smooth morti con batteri rough vivi.[9] Questo sistema, pur non fornendo nessuna evidenza su quale fosse la sostanza che determinava il cambiamento, mostrava che qualcosa potesse trasportare l'informazione genetica dai resti dei batteri morti a quelli vivi. Si parlò quindi di un principio trasformante in grado di modificare i batteri vivi. Nel 1943 Oswald Theodore Avery dimostrò, in un celebre esperimento insieme a Colin MacLeod e Maclyn McCarty, che il DNA è il principio trasformante alla base di questo fenomeno.[10] Il ruolo del DNA nell'ereditarietà è stato provato, infine, nel 1953 da Alfred Hershey e Martha Chase attraverso un altro classico esperimento, che dimostrò che il materiale genetico del fago T2 è effettivamente il DNA.[11]


James Watson (a sinistra) e Francis Crick (a destra), scopritori della struttura a doppia elica del DNA.
Il 1953 è anche l'anno in cui, attraverso ulteriori immagini da diffrazione a raggi X[12] realizzate da Rosalind Franklin, chimica-fisica inglese, James Watson e Francis Crick presentarono[12], sulla rivista Nature, quello che è oggi accertato come il primo modello accurato della struttura del DNA,[13] ovvero il modello a doppia elica. A disegnarne il bozzetto fu Odile Speed, pittrice e moglie di Crick. Le evidenze sperimentali a supporto del modello di Watson e Crick furono riportate in una serie di cinque articoli pubblicati sullo stesso numero di Nature.[14] Tra questi figurava l'articolo della Franklin e di Raymond Gosling, che conteneva i dati di diffrazione a raggi X, fondamentale per sostenere il modello.[15][16] Tale numero conteneva anche un articolo sulla struttura del DNA scritto da Maurice Wilkins.[17] Nel 1962, dopo la morte di Rosalind Franklin (a causa di un tumore provocato, probabilmente, dalle alte dosi di raggi X a cui si era esposta nel corso dei suoi esperimenti), Watson, Crick e Wilkins ricevettero congiuntamente il Premio Nobel per la medicina.[18] Dal momento che la scoperta del modello si basò essenzialmente sui dati di Rosalind Franklin, ancora oggi esistono pareri molto eterogenei nella comunità scientifica su chi avrebbe dovuto ricevere tale premio.
In un'importante presentazione del 1957, Crick propose il dogma centrale della biologia molecolare, che fissa le relazioni tra DNA, RNA e proteine.[19] La conferma finale del meccanismo di replicazione basato sulla struttura a doppia elica fu fornita nel 1958 dall'esperimento di Meselson-Stahl.[20] Un successivo lavoro di Crick dimostrò come il codice genetico fosse basato su triplette di basi non sovrapposte, permettendo ad Har Gobind Khorana, Robert Holley e Marshall Warren Nirenberg di decifrarlo.[21] Queste scoperte sono alla base della moderna
biologia molecolare.
Nel 1961 Marshall Nirenberg e Severo Ochoa scoprono che ogni tripletta di nucleotidi codifica per uno specifico amminoacido.
Composizione |
Struttura a doppia elica del DNA. Sono messi in evidenza gli accoppiamenti tra le quattro basi azotate.
Il DNA è un lungo polimero costituito da unità ripetute di nucleotidi.[22][23] La catena del DNA è larga tra i 22 ed i 26 Ångström (da 2,2 a 2,6 nanometri) ed ogni unità nucleotidica è lunga 3,3 Ångstrom (0,33 nanometri).[24] Sebbene ogni unità occupi uno spazio decisamente ridotto, la lunghezza dei polimeri di DNA può essere sorprendentemente elevata, dal momento che ogni filamento può contenere diversi milioni di nucleotidi. Ad esempio, il più grande cromosoma umano (il cromosoma 1) contiene quasi 250 milioni di paia di basi.[25]
Negli organismi viventi, il DNA non è quasi mai presente sotto forma di singolo filamento, ma come una coppia di filamenti saldamente associati tra loro.[13][26] Essi si intrecciano tra loro a formare una struttura definita doppia elica. Ogni nucleotide è costituito da uno scheletro laterale, che ne permette il legame covalente con i nucleotidi adiacenti, e da una base azotata, che instaura legami idrogeno con la corrispondente base azotata presente sul filamento opposto. Il composto formato da una base azotata legata allo zucchero è definito nucleoside; un nucleotide è invece un nucleoside a cui sono legati uno o più gruppi fosfato.[27]
La struttura laterale del DNA è composta da unità ripetute ed alternate di gruppi fosfato e di 2-deossiribosio,[28] uno zucchero pentoso (a cinque atomi di carbonio) che si lega ai fosfati adiacenti attraverso legami fosfodiesterici presso il terzo ed il quinto carbonio; in pratica, ogni molecola di fosfato forma un ponte molecolare collegando, attraverso legami fosfodiesterici, il carbonio in posizione 3′ di una molecola di deossiribosio con quello in posizione 5′ dello zucchero successivo. Conseguenza di questi legami asimmetrici è che ogni filamento di DNA ha un senso, determinato dalla direzione dei legami fosfodiesterici. Le basi azotate, invece, si uniscono in posizione 1' dello zucchero desossiribosio con legami N-glicosidici. In una doppia elica, il senso di un filamento è opposto a quello del filamento complementare. Per tale motivo, i due filamenti che costituiscono una doppia elica sono detti antiparalleli. Le estremità asimmetriche di un filamento di DNA sono definite estremità 5′ (cinque primo) ed estremità 3′ (tre primo). La principale differenza tra il DNA e l'RNA è lo zucchero pentoso utilizzato: l'RNA, infatti, utilizza il ribosio.[26]
La doppia elica del DNA è stabilizzata dai legami idrogeno che si instaurano tra le basi azotate presenti sui due filamenti.[29] Le quattro basi che sono presenti nel DNA sono l'adenina (abbreviata con la lettera A), la citosina (C), la guanina (G) e la timina (T). Tutte e quattro le basi hanno struttura eterociclica, ma adenina e guanina sono, dal punto di vista strutturale, derivate della purina, e pertanto dette basi puriniche, mentre citosina e timina sono correlate alla pirimidina e dette basi pirimidiniche.[26] Esiste una quinta base, di tipo pirimidinico, chiamata uracile (U), ma essa non è di norma presente nelle catene di DNA. L'uracile è altresì presente nei filamenti di RNA al posto della timina, dalla quale si differenzia per la mancanza di un gruppo metile. L'uracile è presente nel DNA solo come prodotto della degradazione della citosina. Solo nel batteriofago PBS1 tale base può essere utilizzata all'interno del DNA.[30] Al contrario, è molto più frequente individuare la timina all'interno di molecole di RNA, a causa della metilazione enzimatica di diversi uracili. Questo evento avviene solitamente a carico di RNA con funzione strutturale o enzimatica (rRNA e tRNA).[31]
La doppia elica è una spirale destrorsa. Con l'avvitarsi su sé stessi dei due filamenti, restano esposti dei solchi tra i diversi gruppi fosfato. Il solco maggiore è largo 22 Å, mentre il solco minore è largo 12 Å.[32] La differente ampiezza dei due solchi si traduce concretamente in una differente accessibilità delle basi, a seconda che si trovino nel solco maggiore o minore. Proteine che legano il DNA, come i fattori di trascrizione, dunque, solitamente prendono contatto con le basi presenti nel solco maggiore.[33][34]
Appaiamento delle basi |


Ogni tipo di base presente su un filamento forma un legame con la base posta sul filamento opposto. Tale evento è noto come appaiamento complementare. Le basi puriniche formano legami idrogeno con le basi pirimidiniche: A può legare solo T e G può legare solo C. L'associazione di due basi viene comunemente chiamata paio di basi ed è l'unità di misura maggiormente utilizzata per definire la lunghezza di una molecola di DNA. Dal momento che i legami idrogeno non sono covalenti, essi possono esser rotti e riuniti in modo relativamente semplice, poiché questi sono legami ad alta energia. I due filamenti possono essere allontanati tra loro, come avviene per una cerniera, sia dalle alte temperature che da un'azione meccanica (come avviene durante la replicazione del DNA).[35] Conseguenza di questa complementarità è che tutte le informazioni contenute nella doppia elica possono essere duplicate a partire da entrambi i filamenti, evento fondamentale per una corretta replicazione del DNA.[22]
I due tipi di paia di basi formano un numero differente di legami idrogeno: A e T ne formano due, G e C tre. Per tale motivo, la stabilità del legame GC è decisamente maggiore di quello AT. Di conseguenza, la stabilità complessiva di una molecola di DNA è direttamente correlata alla frequenza di GC presenti nella molecola stessa, nonché alla lunghezza dell'elica: una molecola di DNA è dunque tanto più stabile quanto più contiene GC ed è lunga.[36] Un'altra conseguenza di tale evento è il fatto che le regioni di DNA che devono essere separate facilmente contengono un'elevata concentrazione di A e T, come avviene ad esempio per il Pribnow box dei promotori batterici, la cui sequenza è infatti TATAAT.[37]
In laboratorio, la stabilità dell'interazione tra filamenti è misurata attraverso la temperatura necessaria a rompere tutti i legami idrogeno, chiamata temperatura di melting (o Tm). Quando tutti i legami idrogeno sono rotti, i singoli filamenti si separano e possono assumere strutture molto variegate.[38]
La stabilizzazione della doppia elica, in ogni caso, non è dovuta ai soli legami idrogeno, ma anche ad interazioni idrofobiche e di pi stacking.[39]
Senso e antisenso |
.mw-parser-output .vedi-anche{border:1px solid #CCC;font-size:95%;margin-bottom:.5em}.mw-parser-output .vedi-anche td:first-child{padding:0 .5em}.mw-parser-output .vedi-anche td:last-child{width:100%}

Struttura chimica del DNA. Le sequenze possono essere definite senso e non senso.
Una sequenza di DNA è definita senso se la sua sequenza è la stessa del relativo mRNA. La sequenza posta sul filamento opposto è invece detta antisenso. Dal momento che le RNA polimerasi lavorano producendo una copia complementare, il filamento necessario per la trascrizione è l'antisenso. Sia nei procarioti che negli eucarioti vengono prodotte numerose molecole di RNA antisenso a partire dalle sequenze senso. La funzione di questi RNA non codificanti non è stata ancora completamente chiarita.[40] Si ritiene che gli RNA antisenso possano giocare un ruolo nella regolazione dell'espressione genica.[41]
Esistono alcune sequenze di DNA, sia in procarioti che in eucarioti (ma soprattutto nei plasmidi e nei virus) in cui la differenza tra sequenze senso ed antisenso è meno chiara, dal momento che le sequenze di alcuni geni si sovrappongono tra loro.[42] In questi casi, dunque, alcune sequenze rivestono un doppio compito: codificare una proteina se lette in direzione 5'→3′ su un filamento; codificarne un'altra se lette sull'altro (sempre in direzione 5'→3′). Nei batteri, questa sovrapposizione genica è spesso coinvolta nella regolazione della trascrizione,[43] mentre nei virus il fenomeno è dovuto alla necessità di contenere in un piccolo genoma un'elevata quantità di informazioni.[44] Un altro modo di ridurre le dimensioni genomiche è quello individuato da altri virus, che contengono molecole di DNA lineare o circolare a singolo filamento.[45][46]
Superavvolgimento |
Il DNA può essere distorto come avviene per una corda attraverso un processo definito superavvolgimento. Quando il DNA è in uno stato rilassato, un filamento percorre un giro completo intorno all'asse ogni 10.4 paia di basi. Se invece il DNA è distorto, il numero di basi può aumentare o diminuire.[47] Lo stato di superavvolgimento in cui si trova una molecola di DNA è definito topologia. Se il DNA si avvolge nella direzione dell'elica, si parla di superavvolgimento positivo, con le basi strette tra loro in modo più marcato. In caso contrario, si parla di superavvolgimento negativo. In natura, la maggior parte delle molecole di DNA presentano un lieve superavvolgimento negativo, introdotto da enzimi definiti topoisomerasi.[48] Questi enzimi sono anche necessari in processi come la trascrizione e la replicazione del DNA, dal momento che sono in grado di risolvere gli stress topologici indotti dai processi stessi.[49]
Strutture alternative a doppia elica |

Le strutture del DNA A, B e Z
Il DNA esiste in diversi tipi di conformazioni. Esse sono denominate A-DNA, B-DNA, C-DNA, D-DNA,[50] E-DNA,[51] H-DNA,[52] L-DNA,[50] P-DNA[53] e Z-DNA.[28][54] In ogni caso, solo le conformazioni A-DNA, B-DNA e Z-DNA sono state osservate nei sistemi biologici naturali. La conformazione del DNA può dipendere dalla sequenza, dal superavvolgimento, dalla presenza di modificazioni chimiche delle basi o dalle condizioni del solvente, come la concentrazione di ioni metallici.[55] Di tali conformazioni, la conformazione B è la più frequente nelle condizioni standard delle cellule.[56] Le due conformazioni alternative sono differenti dal punto di vista della geometria e delle dimensioni.
La forma A è un'ampia spirale destrorsa (il solco minore è largo ma poco profondo, quello maggiore è più stretto e profondo), con un passo di 2,9 nm (circa 11bp) ed un diametro di 2,5 nm. Tale conformazione è presente in condizioni non fisiologiche, quando il DNA viene disidratato. In condizioni fisiologiche, questa conformazione caratterizza gli eteroduplex di DNA e RNA e i complessi formati dalle associazioni DNA-proteina.[57][58]
La conformazione Z è tipica invece delle sequenze che presentano modificazioni chimiche come la metilazione, e dei tratti di DNA ricchi di basi C e G. Essa assume un andamento sinistrorso, opposto rispetto alla conformazione B.[59] Ha un passo di 4,6 nm ed un diametro di 1,8 nm, il solco maggiore più superficiale e quello minore più stretto; deve il suo nome all'andamento a zig-zag che la caratterizza. Queste strutture inusuali possono essere riconosciute da specifiche Z-DNA-binding proteins, con conseguenze notevoli nella regolazione della trascrizione, anche se non ne sono stati trovati esempi in natura.[60]
Strutture alternative alla doppia elica |

La struttura di un quadruplex di DNA formato da ripetizioni di telomeri. La conformazione dello scheletro laterale è ampiamente differente rispetto alla tipica struttura ad elica. In verde sono evidenziati ioni potassio che stabilizzano la struttura.[61]
Le regioni terminali dei cromosomi lineari sono sequenze ripetute dette telomeri. La funzione principale di tali regioni è quella di permettere alla cellula di replicare le estremità dei cromosomi senza che ci sia perdita di informazioni geniche, dal momento che le DNA polimerasi coinvolte nella replicazione del DNA non sono in grado di replicare le estremità 3' dei cromosomi.[62] Se un cromosoma non avesse telomeri, infatti, diventerebbe un po' più corto ad ogni replicazione, con il rischio di perdere sequenze codificanti. Attraverso un particolare tipo di DNA polimerasi (detto telomerasi), invece, i telomeri mantengono costantemente la loro lunghezza, proteggendo così la parte interna del cromosoma. Nelle cellule umane, i telomeri sono composti da alcune migliaia di ripetizioni di una semplice sequenza costituita da TTAGGG.[63]
Questa sequenza ricca in guanina può stabilizzare le estremità dei cromosomi formando strutture insolite, composte da unità di quattro basi azotate al posto delle canoniche due. Ciò è dovuto all'interazione tra quattro guanine, che formano una struttura planare che si impila sopra ad altre strutture dello stesso tipo, ad ottenere un filamento stabile definito G-quadruplex structure.[64] Tali strutture sono stabilizzate dalla formazione di legami idrogeno che si instaurano tra le sommità delle basi e dalla chelazione con uno ione metallico, situato al centro di ogni unità di quattro basi.[65]
Oltre a queste, i telomeri generano anche strutture circolari, chiamate telomere-loops o T-loops. In questo caso, il singolo filamento di DNA si piega a formare ampie circonferenze, stabilizzate da proteine specifiche che legano i telomeri.[66] Al termine del T-loop, il singolo filamento di DNA prende contatto con un doppio filamento, che si apre e forma una struttura a tripla elica. Questa struttura è chiamata displacement-loop o D-loop.[64]
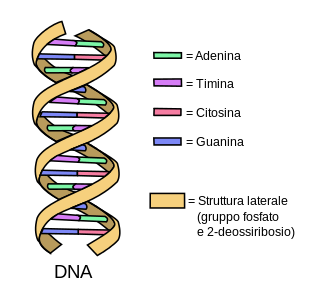
La sua struttura è stata paragonata ad una lunghissima scala a pioli attorcigliata su sé stessa e composta da due montanti (filamenti costituiti da molecole di acido fosforico e di desossiribosio) e da tanti gradini (formati da quattro composti, detti basi azotate: adenina, guanina, citosina e timina). Le basi azotate si legano secondo una regola ben precisa: l'adenina si lega solamente con la timina. La guanina si lega esclusivamente con la citosina. Si dice perciò che le basi azotate adenina-timina e guanina-citosina sono complementari.
L'insieme di acido fosforico + zucchero desossiribosio + base azotata costituisce l'unità di base del DNA: questo insieme è detto nucleotide e si ripete in ciascun filamento per tutta la sua lunghezza. Ogni essere vivente possiede il proprio DNA, che contiene tutte le informazioni genetiche necessarie per controllare le attività dell'organismo. La particolare struttura del DNA ne consente la duplicazione e quindi la sostituzione di eventuali parti mancanti perfettamente uguali all'originale; ciò avviene durante l'interfase quando i cromosomi sono dispersi nel nucleo e hanno l'opportunità di duplicarsi.
La formazione delle proteine, detta sintesi delle proteine o traduzione, avviene nel citoplasma e segue fasi ben precise: il DNA nel nucleo fa da stampo per la formazione dell'RNA messaggero, mediante un processo chiamato trascrizione che è un meccanismo simile a quello della duplicazione. In questo modo la sequenza dei nucleotidi nel mRNA risulta complementare a quella del DNA con la base U al posto della base T.
Modificazioni chimiche |
Modificazioni di basi |


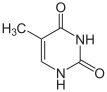
L'espressione genica di un determinato locus è influenzata dalla struttura che la cromatina assume presso il locus stesso. Regioni eterocromatiniche (caratterizzate da una espressione scarsa o assente) sono estesamente metilate sulle citosine. La metilazione della citosina, ad esempio, è fondamentale per l'inattivazione del cromosoma X.[67] Il livello medio di metilazione è molto variabile tra i diversi organismi: Caenorhabditis elegans non presenta metilazione delle citosine, mentre i vertebrati mostrano livelli maggiori, con circa l'1% del genoma contenente 5-metilcitosina.[68] La 5-metilcitosina, essendo suscettibile di deaminazione spontanea, è una base presso cui l'incidenza di mutazioni è elevatissima.[69]
Ulteriori modificazioni di basi sono la metilazione dell'adenina (presente nei batteri) e la glicosilazione dell'uracile che produce le cosiddette basi J nei cinetoplastidi.[70][71]
Danni al DNA |

Il benzopirene è il maggiore agente mutageno presente nel fumo di tabacco. In quest'immagine è riportato un addotto al DNA generato dalla molecola.[72]
Il DNA può essere alterato dall'azione di numerosi agenti, genericamente definiti mutageni; è fondamentale notare però come una mutazione -ovverosia un cambiamento raro, casuale, che alteri la sequenza di basi azotate- non sia necessariamente un evento pernicioso ma anzi sia alla base dell'evoluzione: suddetta mutazione dovrà però farsi spazio nella fittissima rete cibernetica cellulare nonché nell'ambiente nel quale vive ed opera l'organismo vivente in questione; qualora vengano superati questi punti di restrizione (altamente selettivi vista la loro complessità intrinseca, la stragrande maggioranza delle mutazioni difatti si rivela non vantaggiosa od anche neutra), si avrà un organismo arricchito dalla mutazione. Tra gli agenti alteranti figurano ad esempio agenti ossidanti, agenti alchilanti ed anche radiazioni ad alta energia, come i raggi X e gli UV. Il tipo di danno causato al DNA dipende dal tipo di agente: gli UV, ad esempio, danneggiano il DNA generando la formazione di dimeri di timina, costituiti da ponti aberranti che si instaurano tra basi pirimidiniche adiacenti.[73] Agenti ossidanti come i radicali liberi o il perossido di idrogeno, invece, producono danni di tipo più eterogeneo, come modificazioni di basi (in particolare di guanine) o rotture del DNA a doppio filamento.[74] Secondo diversi studi, in ogni cellula umana almeno 500 basi al giorno sono sottoposte a danni ossidativi.[75][76] Di tali lesioni, le più pericolose sono le rotture a doppio filamento, dal momento che tali danni sono i più difficili da riparare e costituiscono l'origine primaria delle mutazioni puntiformi e frameshift che si accumulano sulle sequenze genomiche, nonché delle traslocazioni cromosomiche.[77]
Molti agenti devono il loro potere mutageno alla capacità di intercalarsi tra due basi azotate consecutive. Gli intercalanti sono tipicamente molecole planari e aromatiche, come l'etidio, la daunomicina, la doxorubicina o la talidomide. Perché un intercalante possa trovare posto tra le due basi, occorre che la doppia elica si apra e perda la sua conformazione standard. Tali modifiche strutturali inibiscono sia la trascrizione che la replicazione del DNA ed aumentano la possibilità di insorgenza di mutazioni. Per tale motivo, gli intercalanti sono considerati molecole cancerogene, come dimostrato da numerosi studi su molecole come il benzopirene, l'acridina, l'aflatossina ed il bromuro di etidio.[78][79][80] In ogni caso, proprio grazie alla loro capacità di inibire trascrizione e replicazione, tali molecole sono anche utilizzate in chemioterapia per inibire la rapida crescita delle cellule neoplastiche.[81]
Disposizione del DNA |
Negli eucarioti, il DNA è solitamente presente all'interno di cromosomi lineari (circolari nei procarioti). La somma di tutti i cromosomi di una cellula ne costituisce il genoma; il genoma umano conta circa 3 miliardi di paia di basi contenute in 46 cromosomi.[82]
La disposizione finale a cromosomi segue precise regole gerarchiche di impacchettamento. Nelle cellule, infatti, il doppio filamento di DNA non può essere disposto a casaccio, ma deve seguire precise regole di ordinamento. Tali accorgimenti si rivelano necessari perché la lunghezza dei filamenti di DNA è solitamente molto elevata e creerebbe seri problemi alla cellula ospite. Ad esempio, il cromosoma di Escherichia coli, il procariote più studiato nella storia della biomedicina, misura circa 1 mm. In una cellula lunga solo 2 µm, come quella di E.coli, la disposizione casuale di un cromosoma del genere potrebbe generare problemi. Se una molecola di questa lunghezza si disponesse casualmente, infatti, ci sarebbe bisogno di una cellula grande almeno 1000 volte tanto. Le modalità di impacchettamento sono differenti tra gli organismi procarioti e quelli eucarioti.
Procarioti |

DNA in una cellula procariote.
Nella maggior parte delle cellule batteriche il DNA è disposto su un unico cromosoma circolare (e presenta, come molti altri batteri, un'unica origine di replicazione), come previsto da numerosi esperimenti di linkage ed infine evidenziato in cellule cresciute con timina marcata con tritio.
I meccanismi messi in atto dalla cellula procariote per ridurre lo spazio necessario consistono anzitutto nel mascheramento delle cariche negative presenti sul DNA attraverso la sua associazione con poliammine cariche positivamente, come la spermina e la spermidina. Oltre a queste, il DNA procariote prende contatto anche con numerose piccole proteine, che compattano la struttura complessiva del DNA. Tra di esse, figura H-NS, un dimero con funzioni molto simili agli istoni eucariotici. In ogni cellula di E.coli esistono in media 20000 molecole di H-NS, che si dispongono lungo il DNA a distanza di circa 400bp.
Il DNA di E.coli è inoltre molto superavvolto. Tale fenomeno contribuisce ulteriormente al compattamento del DNA, permettendo ad esso di disporsi comodamente all'interno della cellula.
Eucarioti |
DNA in una cellula eucariote.
Negli eucarioti l'impacchettamento è ottenuto attraverso diversi accorgimenti. Il DNA è associato ad un gran numero di proteine: l'associazione complessiva DNA-proteine è definita cromatina, la cui struttura è ampiamente conservata tra tutti gli organismi eucarioti.
Le proteine cromatiniche più abbondanti sono gli istoni, una famiglia di polipeptidi basici presenti nel nucleo. Le principali proteine istoniche sono H1, H2A, H2B, H3 e H4. La basicità degli istoni è dovuta alla grande quantità di amminoacidi carichi positivamente (lisina e arginina), in grado di instaurare interazioni elettrostatiche con i gruppi fosfato del DNA. Le proteine istoniche sono anche pesantemente modificate, proprio sui residui carichi, da modificazioni post-traduzionali, tra cui l'aggiunta di acetili, di fosfati e di metili, che neutralizzano la carica positiva o la rendono negativa.
Le sequenze amminoacidiche di quattro dei cinque istoni (H2A, H2B, H3 e H4) sono altamente conservate, anche tra specie molto diverse. La sequenza di H1 presenta invece maggiori variazioni lungo l'evoluzione: in alcuni organismi, H1 non è nemmeno presente in tutti i tessuti (ad esempio negli eritrociti degli uccelli H1 è sostituita da un sesto istone, chiamato H5). La presenza di differenti H1, in ogni caso, non modifica sostanzialmente la struttura complessiva dell'apparato istonico (definito nucleosoma), che resta ampiamente conservato nell'architettura nella quasi totalità degli eucarioti.
Funzioni biologiche |
Nel genoma, l'informazione è conservata in sequenze di DNA chiamate geni. La trasmissione dell'informazione contenuta nei geni è garantita dalla presenza di sequenze di basi azotate complementari. Infatti, durante la trascrizione, l'informazione può essere facilmente copiata in un filamento complementare di RNA. Solitamente, tale copia di RNA è utilizzata per sintetizzare una proteina, attraverso un processo definito traduzione (o sintesi proteica). In alternativa, una cellula può semplicemente duplicare l'informazione genetica attraverso un processo definito replicazione del DNA.
Struttura del genoma |
Negli organismi eucarioti, il DNA genomico è localizzato all'interno del nucleo cellulare, nonché in piccole quantità all'interno di mitocondri e cloroplasti. Nei procarioti, il DNA è invece racchiuso in un organello irregolare, privo di membrana, contenuto nel citoplasma, chiamato nucleoide.[83] L'informazione è contenuta all'interno dei geni, unità ereditarie in grado di influire sul fenotipo dell'organismo. Ogni gene contiene un open reading frame (regione in grado di essere trascritta a RNA) ed una regione regolatoria, costituita sia da un promotore che da enhancers.
In molte specie, solo una piccola frazione della sequenza totale di un genoma può essere trascritta e tradotta. Ad esempio, solo l'1,5% del genoma umano è costituito da esoni codificanti una proteina, mentre più del 50% consiste di sequenze ripetute di DNA non codificante.[84] La ragione per cui ci sia una tale quantità di DNA non codificante non è tuttora completamente chiara ed è stata definita come enigma del C-value.[85] In ogni caso, le sequenze di DNA che non codificano una proteina possono essere trascritte in RNA non codificante, coinvolto nella regolazione dell'espressione genica.[86]

Una T7 RNA polimerasi (blu) mentre produce una molecola di mRNA (verde) a partire da uno stampo di DNA (arancione).[87]
Alcune sequenze non codificanti ricoprono un ruolo strutturale per i cromosomi. Le regioni telomeriche e centromeriche contengono solitamente pochissimi geni, ma sono necessarie per la funzione e la stabilità dei cromosomi.[88] Nell'uomo, grandi quantità di DNA non codificante si ritrovano negli pseudogeni, copie di geni rese inattive dalla presenza di una mutazione.[89] Queste sequenze sono considerate come fossili molecolari, anche se esistono evidenze secondo le quali si può ipotizzare che siano una sorta di materiale grezzo necessario per la creazione di nuovi geni attraverso i processi di duplicazione genica e di evoluzione divergente.[90]
Trascrizione e traduzione |
Un gene è una sequenza di DNA che contiene le informazioni in grado di influire sulle caratteristiche del fenotipo dell'organismo. All'interno di un gene, la sequenza di basi di DNA è utilizzata come stampo per la sintesi di una molecola di RNA che, nella maggior parte dei casi, è tradotta in una molecola peptidica.
Il meccanismo attraverso il quale la sequenza nucleotidica di un gene è copiata in un filamento di RNA è detto trascrizione ed avviene per mezzo dell'enzima RNA polimerasi. Il filamento di RNA può andare incontro a destini differenti: alcune molecole di RNA hanno, infatti, funzioni di tipo strutturale (come quelle che si trovano all'interno del ribosoma) o catalitica (molecole note come ribozimi); gli RNA più noti, tuttavia, subiscono un processo di maturazione per produrre mRNA, molecole destinate ad esser tradotte in proteina.
Il processo di traduzione avviene nel citoplasma, dove gli mRNA si associano ai ribosomi, ed è mediato dal codice genetico. Il ribosoma permette la lettura sequenziale dei codoni del mRNA, favorendone il riconoscimento e l'interazione con specifici tRNA, molecole che trasportano gli amminoacidi corrispondenti ad ogni singolo codone.
Il codice genetico |
Il codice genetico consiste di parole di tre lettere chiamate codoni, costituite dalla sequenza di tre nucleotidi (ad esempio ACU, CAG, UUU), presenti sull'mRNA, ognuna delle quali è associata ad un particolare amminoacido. Ad esempio la timina ripetuta in una serie di tre (UUU) codifica la fenilalanina. Utilizzando gruppi di tre lettere si possono avere fino a 64 combinazioni diverse (43{displaystyle 4^{3}}
Replicazione |

La replicazione del DNA: la doppia elica è aperta dalle elicasi e dalle topoisomerasi; in seguito, una DNA polimerasi genera un filamento complementare sul filamento veloce; un'altra DNA polimerasi lega invece il filamento lento, generando segmenti discontinui (detti frammenti di Okazaki) che verranno uniti da una DNA ligasi.
La divisione cellulare, necessaria ad un organismo per crescere, richiede una duplicazione del DNA cellulare, in modo che le cellule figlie possano avere la stessa informazione genetica della cellula madre. La struttura a doppia elica del DNA permette un meccanismo estremamente semplice per la replicazione del DNA. I due filamenti, infatti, sono separati e da ognuno viene creato un filamento complementare, ad opera di un enzima chiamato DNA polimerasi. Con questo meccanismo, le basi presenti sul filamento figlio sono determinate da quelle presenti sul filamento parentale: è proprio attraverso questo meccanismo che le cellule figlie presentano genoma identico alla cellula madre (salvo errori avvenuti durante il processo, che portano alla comparsa di mutazioni). Tale tipo di replicazione, che porta a doppie eliche costituite da un filamento preesistente e uno neoformato è detta semiconservativa.
Per iniziare la replicazione, occorre anzitutto l'apertura della forca replicativa, attraverso la parziale denaturazione del DNA a doppia elica, portata a termine dalle elicasi e dalle single-strand-binding proteins (SSBPs): le elicasi sono enzimi che separano attivamente i due filamenti usando l'energia dell'ATP; le SSBPs sono in grado di mantenere la denaturazione del DNA legandosi esclusivamente alle porzioni a singolo filamento e stabilizzandole. Nelle molecole di DNA circolari dei procarioti si ha una sola regione di origine della replicazione dalla quale partono due forche replicative (la struttura prende il nome di bolla di replicazione). Quando le due forche si incontrano dal lato opposto la replicazione è completata. Negli eucarioti la replicazione di ogni cromosoma inizia invece in più punti.
Le DNA polimerasi, enzimi capaci di costruire una nuova catena solo in direzione 5'-3', sono stati individuati per la prima volta da Arthur Kornberg, il quale, grazie ad un suo famoso esperimento,[91] identificò la DNA polimerasi I in Escherichia coli. La reazione della DNA polimerasi è diretta dallo stampo, perché produce un nuovo filamento di DNA esattamente complementare ad uno preesistente che funge, appunto, da stampo. La DNA polimerasi non è in grado di iniziare la sintesi di un filamento ex novo, mentre può allungare un filamento polinucleotidico preesistente. In una cellula in replicazione, dunque, è indispensabile la presenza di un filamento preesistente (detto primer), che consiste solitamente in un breve segmento di RNA complementare allo stampo, sintetizzato da enzimi specifici detti primasi.
Dal momento che le DNA polimerasi sono in grado di svolgere la loro attività solo in direzione 5'-3', esse hanno messo a punto diversi meccanismi per copiare i due filamenti della doppia elica.[92] Un filamento (chiamato filamento guida) può essere replicato in modo quasi continuo, man mano che viene esposto, l'altro (filamento lento) risulta invece disseminato da brevi filamenti di DNA di nuova sintesi (i frammenti di Okazaki), ognuno dei quali presenta un innesco iniziale di RNA. I nuovi filamenti devono essere quindi completati mediante la rimozione degli inneschi da parte di endonucleasi e il riempimento degli spazi rimasti ad opera di polimerasi di riparazione. Successivamente tutti questi frammenti di DNA di nuova sintesi del filamento lento vengono legati dalle DNA ligasi.
Interazioni con proteine |
Tutte le funzioni del DNA dipendono dalle sue interazioni con specifiche proteine. Tali interazioni possono sia essere aspecifiche, sia prevedere un legame estremamente specifico della proteina ad una singola sequenza di DNA. Sono numerosi anche gli enzimi che possono legare il DNA e, tra questi, sono particolarmente importanti le polimerasi che copiano le sequenze nella trascrizione e nella replicazione del DNA.
Proteine che legano il DNA |
 |
Le proteine strutturali che legano il DNA sono esempi delle interazioni aspecifiche tra DNA e proteine. All'interno dei cromosomi, il DNA è associato a complessi di natura proteica, che si organizzano tra loro a formare una struttura compatta chiamata cromatina. Negli eucarioti, questa struttura presuppone il legame del DNA a piccoli complessi proteici basici chiamati istoni; nei procarioti, invece, sono coinvolti diversi tipi di differenti proteine.[93][94] Gli istoni formano un complesso a forma di disco chiamato nucleosoma, che instaura interazioni di tipo ionico (tra i residui basici degli istoni e lo scheletro fosforico acido del DNA) con circa duecento paia di basi di DNA, che si avvolgono intorno al disco formando due giri completi, indipendentemente dalla sequenza che li caratterizza.[95] Questi residui basici possono subire metilazioni, fosforilazioni e acetilazioni:[96] tali modificazioni chimiche alterano l'interazione tra gli istoni e il DNA, rendendolo così più o meno accessibile ai fattori di trascrizione e modulando la velocità della trascrizione stessa.[97]
Altre DNA-binding proteins (DNAbp) di tipo aspecifico, anch'esse presenti nella cromatina, sono le high-mobility group proteins, che legano preferenzialmente il DNA ripiegato o distorto.[98] Queste proteine hanno un ruolo fondamentale nel ripiegamento delle file di nucleosomi e nel loro impacchettamento all'interno di strutture cromatiniche più complesse.[99]
Un ulteriore gruppo di DNAbp sono le single-strand-binding proteins (SSBP), che si legano esclusivamente ad una molecola di DNA a singolo filamento. Nell'uomo, la RPA (replication protein A) è il membro meglio caratterizzato di questa famiglia ed è essenziale per la maggior parte dei processi che richiedono una separazione della doppia elica, tra cui la replicazione del DNA, la sua ricombinazione e la sua riparazione.[100] Queste DNAbp sono in grado di stabilizzare la forma a singolo filamento, impedendo che la molecola si ripieghi a formare stem loops o venga degradata dall'azione delle nucleasi.

Il repressore lambda, con la sua caratteristica struttura elica-giro-elica, legato al proprio DNA bersaglio[101]
A differenza di quelle finora presentate, esistono anche numerose proteine che legano specificamente determinate sequenze di DNA. Quelle maggiormente studiate sono i fattori di trascrizione (TF), proteine in grado di regolare la trascrizione. Ognuna di esse si lega ad una o più sequenze specifiche, poste solitamente nei pressi del promotore di un gene, attivando o inibendo la trascrizione del gene stesso. Tale processo viene svolto attraverso due tipi di meccanismo: anzitutto, i TF sono in grado di legare, direttamente o attraverso proteine adattatrici, la RNA polimerasi responsabile della trascrizione, localizzandola presso il sito di inizio della trascrizione e favorendone dunque l'avvio;[102] un'altra modalità consiste nel legame tra i TF ed enzimi in grado di modulare metilazioni ed acetilazioni degli istoni presenti presso il promotore, modificando dunque l'accessibilità di quella regione alla polimerasi.[103]
Dal momento che un TF può avere numerose sequenze bersaglio, cambiamenti di attività di un TF possono avere effetti sull'espressione di migliaia di geni.[104] Di conseguenza, queste proteine sono spesso i bersagli finali delle cascate di trasduzione del segnale, che mediano le risposte cellulari agli stimoli interni ed esterni alla cellula. La specificità dei TF per il DNA è legato ai contatti multipli che si instaurano tra la proteina ed il solco maggiore, dove le basi azotate sono maggiormente accessibili.[105]
Enzimi che modificano il DNA |
Nucleasi e ligasi |

L'enzima di restrizione EcoRV (verde) in complesso con il suo DNA substrato[106]
Le nucleasi sono enzimi in grado di tagliare filamenti di DNA, dal momento che catalizzano l'idrolisi del legame fosfodiesterico. Le nucleasi che idrolizzano il DNA partendo dai nucleotidi situati alle estremità dei filamenti sono definite esonucleasi. Sono endonucleasi, invece, quelle che tagliano direttamente all'interno del filamento. Le nucleasi più utilizzate in biologia molecolare, dette enzimi di restrizione, tagliano il DNA in corrispondenza di specifiche sequenze. L'enzima EcoRV, ad esempio, riconosce la sequenza di sei basi 5′-GAT|ATC-3′ ed effettua il taglio presso la linea verticale. In natura, questo enzima protegge i batteri dalle infezioni fagiche, digerendo il DNA del fago quando esso fa il suo ingresso nella cellula batterica.[107]
Generalmente, le nucleasi di restrizione riconoscono particolari sequenze nucleotidiche palindromiche, note come siti di restrizione, nelle quali la stessa sequenza si ripete in direzioni opposte sulle due eliche complementari, e quindi producono dei tagli su entrambi i filamenti. Tali enzimi sono utilizzati ampiamente nelle tecniche che prevedono il subclonaggio di DNA all'interno di vettori. Si crede che le sequenze palindromiche possano essere, oltre a sti di restrizione, anche segnali di riconoscimento per alcune proteine di regolazione oppure segnalare il sito di avvio della replicazione del DNA.
Le DNA ligasi sono enzimi in grado di riunire filamenti di DNA precedentemente tagliati o spezzati, utilizzando energia chimica proveniente da ATP o da NAD.[108] Le ligasi sono particolarmente importanti nella replicazione del filamento lento, dal momento che esse riuniscono i frammenti di Okazaki in un filamento unico. Esse rivestono un ruolo importante anche nella riparazione del DNA e nella ricombinazione genetica.[108]
Topoisomerasi ed elicasi |
Le topoisomerasi sono enzimi che presentano sia un'attività nucleasica che una ligasica. Queste proteine sono in grado di modificare le proprietà topologiche del DNA. Alcune di esse svolgono tale funzione tagliando l'elica di DNA e permettendole di ruotare, riducendo il suo grado di superavvolgimento, per poi procedere alla ligazione delle due estremità.[48] Altre topoisomerasi sono invece in grado di tagliare l'elica e far passare attraverso il sito di rottura una seconda elica, prima di ligare il filamento spezzato.[109] Le topoisomerasi sono necessarie per molti processi che coinvolgono il DNA, come ad esempio la replicazione del DNA e la trascrizione.[49]
Le elicasi sono proteine in grado di utilizzare l'energia chimica presente nei nucleosidi trifosfato, soprattutto ATP, per rompere i legami idrogeno che si instaurano tra le basi azotate, permettendo l'apertura della doppia elica di DNA in singoli filamenti.[110] Questi enzimi sono essenziali per la maggior parte dei processi biologici che coinvolgono enzimi che richiedono un diretto contatto con le basi del DNA.
Polimerasi |
Le polimerasi sono enzimi che sintetizzano catene polinucleotidiche a partire dal nucleosidi trifosfato. Esse funzionano aggiungendo nucleotidi al 3′-OH del precedente nucleotide presente sul filamento. Come conseguenza di ciò, tutte le polimerasi lavorano in direzione 5′-3′.[111] Nel sito attivo di questi enzimi, il nucleoside trifosfato si appaia ad un nucleotide presente su un filamento usato come stampo: ciò permette alle polimerasi di sintetizzare in modo accurato filamenti fedelmente complementari agli stampi. Le polimerasi sono classificate sulla base del tipo di stampo che utilizzano.
La replicazione del DNA richiede una DNA polimerasi DNA-dipendente, in grado cioè di realizzare una perfetta copia di una sequenza di DNA. L'accuratezza è fondamentale in questo processo, motivo per cui molte di queste polimerasi presentano anche un'attività di proofreading (dall'inglese, correzione di bozze). Esse sono infatti in grado di rilevare un errore di appaiamento (o mismatch) tra basi azotate ed attivare un'azione 3' o 5' esonucleasica per rimuovere la base scorretta.[112] Nella maggior parte degli organismi, le DNA polimerasi funzionano all'interno di un più ampio complesso proteico definito replisoma, che consiste anche di numerose subunità accessorie come ad esempio le elicasi.[113]
Le DNA polimerasi RNA-dipendenti sono una classe di polimerasi specializzate nella sintesi di una copia di DNA, usando come stampo un frammento di RNA. Tra di esse figurano la trascrittasi inversa, un enzima virale coinvolto nell'infezione dei retrovirus, e la telomerasi, necessaria per la replicazione dei telomeri.[62][114] La telomerasi è una polimerasi inusuale, dal momento che contiene una sequenza stampo di RNA all'interno della propria struttura.
La trascrizione è invece svolta da RNA polimerasi DNA-dipendenti, che legano il DNA presso il promotore di un gene e separano i due filamenti. Successivamente, l'enzima genera una molecola di mRNA fino al raggiungimento del terminatore, dove si interrompe la trascrizione e l'enzima si distacca dal DNA. Come avviene per le DNA polimerasi DNA-dipendenti, anche queste polimerasi operano all'interno di un ampio complesso proteico, composto di molecole accessorie e regolatorie.[115]
Ricombinazione genetica |

La ricombinazione consiste di una rottura e successiva riunione di due cromosomi (M ed F) a produrre due cromosomi riarrangiati (C1 e C2).
 |
 |
Un filamento di DNA solitamente non interagisce con altri segmenti di DNA e, nelle cellule umane, i differenti cromosomi occupano addirittura regioni separate del nucleo (territori cromosomici).[117] Tale separazione fisica è fondamentale per permettere al DNA di essere un archivio stabile e sicuro dell'informazione genetica. L'interazione tra diversi segmenti di DNA è invece possibile e frequente attraverso il fenomeno del crossing-over, che permette la ricombinazione genetica attraverso la rottura di due eliche, lo scambio di segmenti tra di esse ed il ricongiungimento finale.
La ricombinazione permette ai cromosomi di scambiare informazioni genetiche e produrre nuove combinazioni di geni, con il risultato di aumentare l'efficienza della selezione naturale e di facilitare l'evoluzione di nuove proteine.[118] La ricombinazione genetica può anche essere coinvolta nella riparazione del DNA, in particolare come risposta cellulare in seguito a rotture a doppio filamento.[119]
La principale forma di crossing-over cromosomico è la ricombinazione omologa, nella quale i due cromosomi coinvolti condividono sequenze molto simili. Le ricombinazioni non omologhe, invece, possono essere dannose per la cellula, perché in grado di produrre traslocazioni cromosomiche e anomalie genetiche. La reazione di ricombinazione è catalizzata da enzimi noti come ricombinasi.[120] Il primo passaggio del processo di ricombinazione consiste nella rottura a singolo filamento provocata da una endonucleasi o da un danno al DNA.[121] Una serie di passaggi successivi, in parte catalizzati dalla ricombinasi, porta all'unione tra due eliche attraverso la formazione di una giunzione di Holliday, nella quale un segmento a singolo filamento di ogni elica è appaiato al filamento complementare presente sull'altra elica. La reazione di ricombinazione è quindi interrotta dalla rottura della giunzione e dalla re-ligazione del DNA così ottenuto.[122]
L'esistenza della giunzione di Holliday è stata dimostrata da fotografie al microscopio elettronico di molecole di DNA in ricombinazione.
Evoluzione del metabolismo del DNA |
Il DNA contiene l'informazione genetica che permette a tutti gli organismi viventi (esclusi i virus, la cui ammissibilità tra i viventi è tuttavia ampiamente dibattuta) di funzionare, crescere e riprodursi. In ogni caso, non è stato ancora chiarito in quale momento della storia della vita il DNA abbia assunto tale ruolo fondamentale. È generalmente accettato dalla comunità scientifica, infatti, l'ipotesi che il DNA non sia stato il primo acido nucleico ad essere utilizzato dai viventi: tale ruolo spetterebbe infatti all'RNA.[123][124] L'RNA potrebbe aver giocato un ruolo centrale del metabolismo cellulare ancestrale, dal momento che può avere sia un ruolo nella conservazione dell'informazione genetica, sia uno catalitico (ad esempio attraverso i ribozimi), sia uno strutturale (all'interno dei ribosomi).[125] Il mondo a RNA, basato su un unico tipo di molecola avente funzioni genetiche, catalitiche e strutturali, potrebbe avere avuto un'influenza sullo sviluppo dell'attuale codice genetico, basato proprio su quattro nucleotidi. Tale numero potrebbe essere un compromesso tra la necessità da una parte di ridurre la quantità di basi possibili, per migliorare l'accuratezza della replicazione, e dall'altra di aumentarla, per incrementare l'efficacia catalitica dei ribozimi.[126]
Non si conoscono fossili di DNA risalenti all'origine della vita (dopo il mondo a RNA) per poterne studiare l'evoluzione molecolare, dal momento che è impossibile recuperare DNA dai fossili. Ciò è dovuto al fatto che il DNA può sopravvivere nell'ambiente per meno di un milione di anni e, se in soluzione, si degrada rapidamente in piccoli frammenti.[127] Sebbene ci siano stati diversi annunci di scoperte di DNA antichissimo, tra cui quella relativa all'isolamento di un batterio vivo da un cristallo di sale risalente a 250 milioni di anni fa,[128] queste affermazioni sono controverse.[129][130]
Utilizzi del DNA |
Ingegneria genetica |
La moderna biologia e biochimica fa un uso intensivo del DNA. Con il termine di DNA ricombinante ci si riferisce a segmenti di DNA realizzati e assemblati artificialmente. Essi possono essere inseriti all'interno di organismi viventi sotto forma di plasmidi o mediante altri tipi di vettori.[131] Gli organismi così prodotti sono detti geneticamente modificati e possono essere utilizzati per la produzione di proteine ricombinanti, necessarie per la ricerca biomedica,[132] o per le coltivazioni agricole.[133][134]
Medicina forense |
La medicina forense si serve del DNA, generalmente isolato dal sangue, dalla pelle, dalla saliva, dai capelli e da altri tessuti e fluidi biologici, per identificare i responsabili di atti criminosi, come delitti o violenze. Il processo utilizzato è il fingerprinting genetico: tale tecnica consiste nel comparare la lunghezza delle sezioni variabili del DNA ripetitivo, come le short tandem repeats ed i minisatelliti, che possono risultare molto diverse tra un individuo e l'altro. La comparazione tra due campioni di DNA in esame, non si basa perciò sull'analisi di tutta la sequenza desossiribonucleotidica, ma solo su tali sezioni. Infatti, due individui non legati da rapporti di parentela hanno in comune ben il 99,9% di sequenza di DNA. Tale metodo è solitamente molto affidabile,[135] anche se a volte l'identificazione dei criminali può risultare complicata qualora la scena sia contaminata dal DNA di diverse persone.[136] Questo metodo, sviluppato nel 1984 dal genetista britannico Sir Alec Jeffreys,[137] fu usato per la prima volta nel 1988 per incriminare Colin Pitchfork. Nella pratica attuale, spesso i sospettati sono invitati a fornire un campione di DNA per il confronto con eventuali reperti biologici presenti sulla scena del delitto. Il fingerprinting genetico può essere utilizzato anche per identificare le vittime di incidenti di massa.
Bioinformatica |
La bioinformatica è una branca della biologia che comprende la manipolazione, la ricerca ed il data mining dei dati relativi a sequenze di DNA. Lo sviluppo di tecniche utili ad immagazzinare e ricercare sequenze di DNA, infatti, ha condotto ad ampi sviluppi dell'informatica applicata alla biologia molecolare, specialmente per quanto riguarda gli algoritmi di ricerca di stringhe e l'apprendimento automatico.[138] Gli algoritmi di ricerca (o appaiamento) di stringhe, in grado di individuare la presenza di una sequenza di lettere all'interno di sequenze molto più ampie, furono inizialmente sviluppati per la ricerca di specifiche sequenze nucleotidiche.[139]
Esistono da molto tempo, ovviamente, semplici algoritmi in grado di affrontare questi problemi (quelli presenti, ad esempio, negli editor di testo), ma l'analisi del DNA, che si presenta come composto di sole quattro lettere, richiede programmi più elaborati. Il problema immediatamente correlato dell'allineamento di sequenze si pone come obiettivo quello di identificare le sequenze omologhe ed individuare le specifiche mutazioni che le rendono differenti. Queste tecniche, in particolare l'allineamento di sequenze multiple, sono utilizzate per studiare le relazioni filogenetiche e la funzione delle proteine.[140] Esistono anche algoritmi di ricerca genetica.
La grande quantità di dati ottenuta da progetti come il progetto genoma umano è infatti di difficile utilizzo senza una prima analisi che permetta di localizzare i geni e le regioni regolatorie sui cromosomi. Tali algoritmi, dunque, sono in grado di riconoscere regioni putative di presenza di geni codificanti RNA o proteine.[141]
DNA in informatica e nanotecnologie |

La struttura di DNA presente a sinistra è in grado di autoassemblarsi nella configurazione presente a destra. L'uso del DNA nelle nanotecnologie sfrutta le proprietà di riconoscimento molecolare tipiche del DNA[142]
Il DNA è stato utilizzato in informatica per la prima volta per risolvere un semplice problema di cammino hamiltoniano, un problema NP-completo.[143] Il calcolo attraverso il DNA è più vantaggioso rispetto a quello classico per via elettronica sia dal punto di vista dell'energia consumata, sia da quello dello spazio utilizzato: strutture di questo genere sono infatti in grado di svolgere calcoli in modalità parallele che permettono di risolvere agevolmente numerosi altri problemi quali la simulazione di macchine astratte, il problema di soddisfacibilità booleana e la versione bounded del problema del commesso viaggiatore.[144] Grazie alla sua compattezza, il DNA presenta anche un ruolo (almeno teorico) nel campo della crittografia, nella quale permetterebbe in particolare la costituzione e l'utilizzo efficiente di cifrari di Vernam sicuri.[145]
Il DNA è utilizzato anche nel campo delle nanotecnologie poiché presenta proprietà di riconoscimento molecolare che lo rendono in grado di auto-assemblarsi in strutture complesse di tipo bidimensionale o poliedrico. Tali assemblati sono utilizzati con funzioni essenzialmente strutturali e non come vettori di informazione biologica.[146]
Storia e antropologia |

Albero filogenetico delle miosine[147]
Dal momento che il DNA è sottoposto nel tempo a mutazioni che vengono ereditate, esso contiene informazioni preziose che possono essere utilizzate dai genetisti per studiare l'evoluzione degli organismi e la loro filogenesi.[148] Sulla base delle diverse mutazioni presenti in geni estremamente conservati tra gli organismi (oppure, tramite algoritmi comparativi bioinformatici più avanzati, confrontando direttamente interi genomi) i genetisti sono in grado di ricostruire alberi filogenetici in grado di descrivere l'evoluzione di diverse specie anche molto diverse tra loro.[149][150] Studiando le mutazioni accumulatesi nel tempo, è anche possibile ricostruire alberi che descrivano l'evoluzione all'interno di famiglie di proteine.
Comparando le sequenze di DNA all'interno di una stessa specie, inoltre, è possibile studiare la storia genetica di particolari popolazioni. Ciò presenta una notevole rilevanza sia per analisi ecologiche sia per studi antropologici: il DNA è stato usato, ad esempio, per ricostruire la vicenda delle dieci tribù perdute d'Israele.[151]
Note |
^ ADN, in Treccani.it – Vocabolario Treccani on line, Istituto dell'Enciclopedia Italiana, 15 marzo 2011. URL consultato il 27 aprile 2017.
^ Lemma "ADN" in Tullio De Mauro, Dizionario italiano.
^ Cfr. "DNA o ADN" nell'enciclopedia Sapere.
^ Esistono numerosi virus privi di DNA, ma la loro classificazione come organismi viventi è tuttora dibattuta
^ Dahm R, Friedrich Miescher and the discovery of DNA, in Dev Biol, vol. 278, nº 2, 2005, pp. 274–88, PMID 15680349.
^ Levene P,, The structure of yeast nucleic acid, in J Biol Chem, vol. 40, nº 2, 1919, pp. 415–24.
^ Astbury W,, Nucleic acid, in Symp. SOC. Exp. Bbl, vol. 1, nº 66, 1947.
^ Erwin Schrödinger - What is Life? The Physical Aspect of the Living Cell, Cambridge University Press, Cambridge 1944
^ Lorenz MG, Wackernagel W, Bacterial gene transfer by natural genetic transformation in the environment, in Microbiol. Rev., vol. 58, nº 3, 1994, pp. 563–602, PMID 7968924.
^ Avery O, MacLeod C, McCarty M, Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III, in J Exp Med, vol. 79, nº 2, 1944, pp. 137–158.
^ Hershey A, Chase M, Independent functions of viral protein and nucleic acid in growth of bacteriophage (PDF), in J Gen Physiol, vol. 36, nº 1, 1952, pp. 39–56, PMID 12981234.
^ ab Watson J.D. and Crick F.H.C. "A Structure for Deoxyribose Nucleic Acid". (PDF) Nature 171, 737–738 (1953). Ultimo accesso: 13 febbraio 2007.
^ ab Watson J, Crick F, Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid (PDF), in Nature, vol. 171, nº 4356, 1953, pp. 737–8, PMID 13054692.
^ Nature Archives Double Helix of DNA: 50 Years
^ Molecular Configuration in Sodium Thymonucleate. Franklin R. and Gosling R.G.Nature 171, 740–741 (1953) Nature Archives Full Text (PDF)
^ Original X-ray diffraction image
^ Molecular Structure of Deoxypentose Nucleic Acids. Wilkins M.H.F., A.R. Stokes A.R. & Wilson, H.R. Nature 171, 738–740 (1953)Nature Archives (PDF)
^ The Nobel Prize in Physiology or Medicine 1962 Nobelprize.org. Ultimo accesso: 22 dicembre 2006
^ Crick, F.H.C. On degenerate templates and the adaptor hypothesis (PDF). Archiviato il 1º ottobre 2008 in Internet Archive. genome.wellcome.ac.uk (Lecture, 1955). Ultimo accesso: 22 dicembre 2006
^ Meselson M, Stahl F, The replication of DNA in Escherichia coli, in Proc Natl Acad Sci U S A, vol. 44, nº 7, 1958, pp. 671–82, PMID 16590258.
^ The Nobel Prize in Physiology or Medicine 1968 Nobelprize.org. Ultimo accesso: 22 dicembre 2006
^ ab Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters, Molecular Biology of the Cell; Fourth Edition, New York and London, Garland Science, 2002, ISBN 0-8153-3218-1.
^ Butler, John M. (2001) Forensic DNA Typing "Elsevier". pp. 14–15. ISBN 978-0-12-147951-0.
^ Mandelkern M, Elias J, Eden D, Crothers D, The dimensions of DNA in solution, in J Mol Biol, vol. 152, nº 1, 1981, pp. 153–61, PMID 7338906.
^ Gregory S, et al., The DNA sequence and biological annotation of human chromosome 1, in Nature, vol. 441, nº 7091, 2006, pp. 315–21, PMID 16710414.
^ abc Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
^ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Ultimo accesso: 3 gennaio 2006
^ ab Ghosh A, Bansal M, A glossary of DNA structures from A to Z, in Acta Crystallogr D Biol Crystallogr, vol. 59, Pt 4, 2003, pp. 620–6, PMID 12657780.
^ (EN) IUPAC Gold Book, "deoxyribonucleic acids (DNA)"
^ Takahashi I, Marmur J., Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis, in Nature, vol. 197, 1963, pp. 794–5, PMID 13980287.
^ Agris P, Decoding the genome: a modified view, in Nucleic Acids Res, vol. 32, nº 1, 2004, pp. 223–38, PMID 14715921.
^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R, Crystal structure analysis of a complete turn of B-DNA, in Nature, vol. 287, nº 5784, 1980, pp. 755–8, PMID 7432492.
^ Pabo C, Sauer R, Protein-DNA recognition, in Annu Rev Biochem, vol. 53, 1984, pp. 293–321, PMID 6236744.
^ Tra le eccezioni a questa regola, si ricordano le proteine con dominio di legame al DNA di tipo HMG-box, quale HMGB1.
^ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub H, Mechanical stability of single DNA molecules, in Biophys J, vol. 78, nº 4, 2000, pp. 1997–2007, PMID 10733978.
^ Chalikian T, Völker J, Plum G, Breslauer K, A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques, in Proc Natl Acad Sci U S A, vol. 96, nº 14, 1999, pp. 7853–8, PMID 10393911.
^ deHaseth P, Helmann J, Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA, in Mol Microbiol, vol. 16, nº 5, 1995, pp. 817–24, PMID 7476180.
^ Isaksson J, Acharya S, Barman J, Cheruku P, Chattopadhyaya J, Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern, in Biochemistry, vol. 43, nº 51, 2004, pp. 15996–6010, PMID 15609994.
^ Ponnuswamy P, Gromiha M, On the conformational stability of oligonucleotide duplexes and tRNA molecules, in J Theor Biol, vol. 169, nº 4, 1994, pp. 419–32, PMID 7526075.
^ Hüttenhofer A, Schattner P, Polacek N, Non-coding RNAs: hope or hype?, in Trends Genet, vol. 21, nº 5, 2005, pp. 289–97, PMID 15851066.
^ Munroe S, Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns, in J Cell Biochem, vol. 93, nº 4, 2004, pp. 664–71, PMID 15389973.
^ Makalowska I, Lin C, Makalowski W, Overlapping genes in vertebrate genomes, in Comput Biol Chem, vol. 29, nº 1, 2005, pp. 1–12, PMID 15680581.
^ Johnson Z, Chisholm S, Properties of overlapping genes are conserved across microbial genomes, in Genome Res, vol. 14, nº 11, 2004, pp. 2268–72, PMID 15520290.
^ Lamb R, Horvath C, Diversity of coding strategies in influenza viruses, in Trends Genet, vol. 7, nº 8, 1991, pp. 261–6, PMID 1771674.
^ Davies J, Stanley J, Geminivirus genes and vectors, in Trends Genet, vol. 5, nº 3, 1989, pp. 77–81, PMID 2660364.
^ Berns K, Parvovirus replication, in Microbiol Rev, vol. 54, nº 3, 1990, pp. 316–29, PMID 2215424.
^ Benham C, Mielke S, DNA mechanics, in Annu Rev Biomed Eng, vol. 7, 2005, pp. 21–53, PMID 16004565.
^ ab Champoux J, DNA topoisomerases: structure, function, and mechanism, in Annu Rev Biochem, vol. 70, 2001, pp. 369–413, PMID 11395412.
^ ab Wang J, Cellular roles of DNA topoisomerases: a molecular perspective, in Nat Rev Mol Cell Biol, vol. 3, nº 6, 2002, pp. 430–40, PMID 12042765.
^ ab Hayashi G, Hagihara M, Nakatani K, Application of L-DNA as a molecular tag, in Nucleic Acids Symp Ser (Oxf), vol. 49, 2005, pp. 261–262, PMID 17150733.
^ Vargason JM, Eichman BF, Ho PS, The extended and eccentric E-DNA structure induced by cytosine methylation or bromination, in Nature Structural Biology, vol. 7, 2000, pp. 758–761, PMID 10966645.
^ Wang G, Vasquez KM, Non-B DNA structure-induced genetic instability, in Mutat Res, vol. 598, 1–2, 2006, pp. 103–119, PMID 16516932.
^ Allemand, et al, Stretched and overwound DNA forms a Pauling-like structure with exposed bases, in PNAS, vol. 24, 1998, pp. 14152-14157, PMID 9826669.
^ Palecek E, Local supercoil-stabilized DNA structures, in Critical Reviews in Biochemistry and Molecular Biology, vol. 26, nº 2, 1991, pp. 151–226, PMID 1914495.
^ Basu H, Feuerstein B, Zarling D, Shafer R, Marton L, Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies, in J Biomol Struct Dyn, vol. 6, nº 2, 1988, pp. 299–309, PMID 2482766.
^ Leslie AG, Arnott S, Chandrasekaran R, Ratliff RL, Polymorphism of DNA double helices, in J. Mol. Biol., vol. 143, nº 1, 1980, pp. 49–72, PMID 7441761.
^ Wahl M, Sundaralingam M, Crystal structures of A-DNA duplexes, in Biopolymers, vol. 44, nº 1, 1997, pp. 45–63, PMID 9097733.
^ Lu XJ, Shakked Z, Olson WK, A-form conformational motifs in ligand-bound DNA structures, in J. Mol. Biol., vol. 300, nº 4, 2000, pp. 819-40, PMID 10891271.
^ Rothenburg S, Koch-Nolte F, Haag F, DNA methylation and Z-DNA formation as mediators of quantitative differences in the expression of alleles, in Immunol Rev, vol. 184, pp. 286–98, PMID 12086319.
^ Oh D, Kim Y, Rich A, Z-DNA-binding proteins can act as potent effectors of gene expression in vivo, in Proc. Natl. Acad. Sci. U.S.A., vol. 99, nº 26, 2002, pp. 16666-71, PMID 12486233.
^ Immagine realizzata da NDB UD0017 Archiviato il 7 giugno 2013 in Internet Archive.
^ ab Greider C, Blackburn E, Identification of a specific telomere terminal transferase activity in Tetrahymena extracts, in Cell, vol. 43, 2 Pt 1, 1985, pp. 405–13, PMID 3907856.
^ Wright W, Tesmer V, Huffman K, Levene S, Shay J, Normal human chromosomes have long G-rich telomeric overhangs at one end, in Genes Dev, vol. 11, nº 21, 1997, pp. 2801–9, PMID 9353250.
^ ab Burge S, Parkinson G, Hazel P, Todd A, Neidle S, Quadruplex DNA: sequence, topology and structure, in Nucleic Acids Res, vol. 34, nº 19, 2006, pp. 5402–15, PMID 17012276.
^ Parkinson G, Lee M, Neidle S, Crystal structure of parallel quadruplexes from human telomeric DNA, in Nature, vol. 417, nº 6891, 2002, pp. 876–80, PMID 12050675.
^ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T, Mammalian telomeres end in a large duplex loop, in Cell, vol. 97, nº 4, 1999, pp. 503–14, PMID 10338214.
^ Klose R, Bird A, Genomic DNA methylation: the mark and its mediators, in Trends Biochem Sci, vol. 31, nº 2, 2006, pp. 89–97, PMID 16403636.
^ Bird A, DNA methylation patterns and epigenetic memory, in Genes Dev, vol. 16, nº 1, 2002, pp. 6–21, PMID 11782440.
^ Walsh C, Xu G, Cytosine methylation and DNA repair, in Curr Top Microbiol Immunol, vol. 301, pp. 283–315, PMID 16570853.
^ Ratel D, Ravanat J, Berger F, Wion D, N6-methyladenine: the other methylated base of DNA, in Bioessays, vol. 28, nº 3, 2006, pp. 309–15, PMID 16479578.
^ Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P, Borst P, beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei, in Cell, vol. 75, nº 6, 1993, pp. 1129–36, PMID 8261512.
^ Immagine realizzata a partire dalla entry PDB 1JDG
^ Douki T, Reynaud-Angelin A, Cadet J, Sage E, Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation, in Biochemistry, vol. 42, nº 30, 2003, pp. 9221–6, PMID 12885257.
^ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S, Hydroxyl radicals and DNA base damage, in Mutat Res, vol. 424, 1–2, 1999, pp. 9–21, PMID 10064846.
^ Shigenaga M, Gimeno C, Ames B, Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage, in Proc Natl Acad Sci U S A, vol. 86, nº 24, 1989, pp. 9697–701, PMID 2602371.
^ Cathcart R, Schwiers E, Saul R, Ames B, Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage (PDF), in Proc Natl Acad Sci U S A, vol. 81, nº 18, 1984, pp. 5633–7, PMID 6592579.
^ Valerie K, Povirk L, Regulation and mechanisms of mammalian double-strand break repair, in Oncogene, vol. 22, nº 37, 2003, pp. 5792–812, PMID 12947387.
^ Ferguson L, Denny W, The genetic toxicology of acridines, in Mutat Res, vol. 258, nº 2, 1991, pp. 123–60, PMID 1881402.
^ Jeffrey A, DNA modification by chemical carcinogens, in Pharmacol Ther, vol. 28, nº 2, 1985, pp. 237–72, PMID 3936066.
^ Stephens T, Bunde C, Fillmore B, Mechanism of action in thalidomide teratogenesis, in Biochem Pharmacol, vol. 59, nº 12, 2000, pp. 1489–99, PMID 10799645.
^ Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A, Intercalators as anticancer drugs, in Curr Pharm Des, vol. 7, nº 17, 2001, pp. 1745–80, PMID 11562309.
^ Venter J, et al., The sequence of the human genome, in Science, vol. 291, nº 5507, 2001, pp. 1304–51, PMID 11181995.
^ Thanbichler M, Wang S, Shapiro L, The bacterial nucleoid: a highly organized and dynamic structure, in J Cell Biochem, vol. 96, nº 3, 2005, pp. 506–21, PMID 15988757.
^ Wolfsberg T, McEntyre J, Schuler G, Guide to the draft human genome, in Nature, vol. 409, nº 6822, 2001, pp. 824–6, PMID 11236998.
^ Gregory T, The C-value enigma in plants and animals: a review of parallels and an appeal for partnership, in Ann Bot (Lond), vol. 95, nº 1, 2005, pp. 133–46, PMID 15596463.
^ The ENCODE Project Consortium, Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project, in Nature, vol. 447, nº 7146, 2007, pp. 799-816, DOI:10.1038/nature05874.
^ Realizzata a partire dall'entry PDB 1MSW
^ Pidoux A, Allshire R, The role of heterochromatin in centromere function, in Philos Trans R Soc Lond B Biol Sci, vol. 360, nº 1455, 2005, pp. 569–79, PMID 15905142.
^ Harrison P, Hegyi H, Balasubramanian S, Luscombe N, Bertone P, Echols N, Johnson T, Gerstein M, Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22, in Genome Res, vol. 12, nº 2, 2002, pp. 272–80, PMID 11827946.
^ Harrison P, Gerstein M, Studying genomes through the aeons: protein families, pseudogenes and proteome evolution, in J Mol Biol, vol. 318, nº 5, 2002, pp. 1155–74, PMID 12083509.
^ Animazione esplicativa dell'esperimento di Kornberg del 1958)
^ Albà M, Replicative DNA polymerases, in Genome Biol, vol. 2, nº 1, 2001, pp. REVIEWS3002, PMID 11178285.
^ Sandman K, Pereira S, Reeve J, Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome, in Cell Mol Life Sci, vol. 54, nº 12, 1998, pp. 1350–64, PMID 9893710.
^ Dame RT, The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin, in Mol. Microbiol., vol. 56, nº 4, 2005, pp. 858-70, PMID 15853876.
^ Luger K, Mäder A, Richmond R, Sargent D, Richmond T, Crystal structure of the nucleosome core particle at 2.8 A resolution, in Nature, vol. 389, nº 6648, 1997, pp. 251–60, PMID 9305837.
^ Jenuwein T, Allis C, Translating the histone code, in Science, vol. 293, nº 5532, 2001, pp. 1074–80, PMID 11498575.
^ Ito T, Nucleosome assembly and remodelling, in Curr Top Microbiol Immunol, vol. 274, pp. 1–22, PMID 12596902.
^ Thomas J, HMG1 and 2: architectural DNA-binding proteins, in Biochem Soc Trans, vol. 29, Pt 4, 2001, pp. 395–401, PMID 11497996.
^ Grosschedl R, Giese K, Pagel J, HMG domain proteins: architectural elements in the assembly of nucleoprotein structures, in Trends Genet, vol. 10, nº 3, 1994, pp. 94–100, PMID 8178371.
^ Iftode C, Daniely Y, Borowiec J, Replication protein A (RPA): the eukaryotic SSB, in Crit Rev Biochem Mol Biol, vol. 34, nº 3, 1999, pp. 141–80, PMID 10473346.
^ Realizzato a partire dalla entry PDB 1LMB
^ Myers L, Kornberg R, Mediator of transcriptional regulation, in Annu Rev Biochem, vol. 69, 2000, pp. 729–49, PMID 10966474.
^ Spiegelman B, Heinrich R, Biological control through regulated transcriptional coactivators, in Cell, vol. 119, nº 2, 2004, pp. 157-67, PMID 15479634.
^ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B, A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells, in Proc Natl Acad Sci U S A, vol. 100, nº 14, 2003, pp. 8164–9, PMID 12808131.
^ Pabo C, Sauer R, Protein-DNA recognition, in Annu Rev Biochem, vol. 53, 1984, pp. 293–321, PMID 6236744.
^ Immagine realizzata a partire dalla entry PDB 1RVA
^ Bickle T, Krüger D, Biology of DNA restriction, in Microbiol Rev, vol. 57, nº 2, 1993, pp. 434–50, PMID 8336674.
^ ab Doherty A, Suh S, Structural and mechanistic conservation in DNA ligases., in Nucleic Acids Res, vol. 28, nº 21, 2000, pp. 4051–8, PMID 11058099.
^ Schoeffler A, Berger J, Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism, in Biochem Soc Trans, vol. 33, Pt 6, 2005, pp. 1465–70, PMID 16246147.
^ Tuteja N, Tuteja R, Unraveling DNA helicases. Motif, structure, mechanism and function .mw-parser-output .chiarimento{background:#ffeaea;color:#444444}.mw-parser-output .chiarimento-apice{color:red}
[collegamento interrotto], in Eur J Biochem, vol. 271, nº 10, 2004, pp. 1849–63, PMID 15128295.
^ Joyce C, Steitz T, Polymerase structures and function: variations on a theme?, in J Bacteriol, vol. 177, nº 22, 1995, pp. 6321–9, PMID 7592405.
^ Hubscher U, Maga G, Spadari S, Eukaryotic DNA polymerases, in Annu Rev Biochem, vol. 71, 2002, pp. 133–63, PMID 12045093.
^ Johnson A, O'Donnell M, Cellular DNA replicases: components and dynamics at the replication fork, in Annu Rev Biochem, vol. 74, 2005, pp. 283–315, PMID 15952889.
^ Tarrago-Litvak L, Andréola M, Nevinsky G, Sarih-Cottin L, Litvak S, The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention, in FASEB J, vol. 8, nº 8, 1994, pp. 497–503, PMID 7514143.
^ Martinez E, Multi-protein complexes in eukaryotic gene transcription, in Plant Mol Biol, vol. 50, nº 6, 2002, pp. 925–47, PMID 12516863.
^ Immagine realizzata a partire dalla entry PDB 1M6G
^ Cremer T, Cremer C, Chromosome territories, nuclear architecture and gene regulation in mammalian cells, in Nat Rev Genet, vol. 2, nº 4, 2001, pp. 292–301, PMID 11283701.
^ Pál C, Papp B, Lercher M, An integrated view of protein evolution, in Nat Rev Genet, vol. 7, nº 5, 2006, pp. 337–48, PMID 16619049.
^ O'Driscoll M, Jeggo P, The role of double-strand break repair - insights from human genetics, in Nat Rev Genet, vol. 7, nº 1, 2006, pp. 45–54, PMID 16369571.
^ Vispé S, Defais M, Mammalian Rad51 protein: a RecA homologue with pleiotropic functions, in Biochimie, vol. 79, 9-10, 1997, pp. 587-92, PMID 9466696.
^ Neale MJ, Keeney S, Clarifying the mechanics of DNA strand exchange in meiotic recombination, in Nature, vol. 442, nº 7099, 2006, pp. 153-8, PMID 16838012.
^ Dickman M, Ingleston S, Sedelnikova S, Rafferty J, Lloyd R, Grasby J, Hornby D, The RuvABC resolvasome, in Eur J Biochem, vol. 269, nº 22, 2002, pp. 5492–501, PMID 12423347.
^ Joyce G, The antiquity of RNA-based evolution, in Nature, vol. 418, nº 6894, 2002, pp. 214–21, PMID 12110897.
^ Orgel L, Prebiotic chemistry and the origin of the RNA world (PDF), in Crit Rev Biochem Mol Biol, vol. 39, nº 2, pp. 99–123, PMID 15217990.
^ Davenport R, Ribozymes. Making copies in the RNA world, in Science, vol. 292, nº 5520, 2001, p. 1278, PMID 11360970.
^ Szathmáry E, What is the optimum size for the genetic alphabet? (PDF), in Proc Natl Acad Sci U S A, vol. 89, nº 7, 1992, pp. 2614–8, PMID 1372984.
^ Lindahl T, Instability and decay of the primary structure of DNA, in Nature, vol. 362, nº 6422, 1993, pp. 709–15, PMID 8469282.
^ Vreeland R, Rosenzweig W, Powers D, Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal, in Nature, vol. 407, nº 6806, 2000, pp. 897–900, PMID 11057666.
^ Hebsgaard M, Phillips M, Willerslev E, Geologically ancient DNA: fact or artefact?, in Trends Microbiol, vol. 13, nº 5, 2005, pp. 212–20, PMID 15866038.
^ Nickle D, Learn G, Rain M, Mullins J, Mittler J, Curiously modern DNA for a "250 million-year-old" bacterium, in J Mol Evol, vol. 54, nº 1, 2002, pp. 134–7, PMID 11734907.
^ Goff SP, Berg P, Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells, in Cell, vol. 9, 4 PT 2, 1976, pp. 695–705, PMID 189942.
^ Houdebine L, Transgenic animal models in biomedical research, in Methods Mol Biol, vol. 360, pp. 163–202, PMID 17172731.
^ Daniell H, Dhingra A, Multigene engineering: dawn of an exciting new era in biotechnology, in Curr Opin Biotechnol, vol. 13, nº 2, 2002, pp. 136–41, PMID 11950565.
^ Job D, Plant biotechnology in agriculture, in Biochimie, vol. 84, nº 11, 2002, pp. 1105–10, PMID 12595138.
^ Collins A, Morton N, Likelihood ratios for DNA identification (PDF), in Proc Natl Acad Sci U S A, vol. 91, nº 13, 1994, pp. 6007–11, PMID 8016106.
^ Weir B, Triggs C, Starling L, Stowell L, Walsh K, Buckleton J, Interpreting DNA mixtures, in J Forensic Sci, vol. 42, nº 2, 1997, pp. 213–22, PMID 9068179.
^ Jeffreys A, Wilson V, Thein S, Individual-specific 'fingerprints' of human DNA., in Nature, vol. 316, nº 6023, pp. 76–9, PMID 2989708.
^ Baldi, Pierre. Brunak, Soren. Bioinformatics: The Machine Learning Approach MIT Press (2001) ISBN 978-0-262-02506-5
^ Gusfield, Dan. Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press, 15 January 1997. ISBN 978-0-521-58519-4.
^ Sjölander K, Phylogenomic inference of protein molecular function: advances and challenges, in Bioinformatics, vol. 20, nº 2, 2004, pp. 170-9, PMID 14734307.
^ location Mount DM, Bioinformatics: Sequence and Genome Analysis, 2ª ed., Cold Spring Harbor Laboratory Press, 2004, ISBN 0-87969-712-1. Più di un parametro tracognomeeautore
^ Immagine prelevata da Strong M. Protein nanomachines. PLoS Biol. 2004 Mar;2(3):E73. Epub 2004 Mar 16. Entrez PubMed 15024422
^ Adleman L, Molecular computation of solutions to combinatorial problems, in Science, vol. 266, nº 5187, 1994, pp. 1021–4, PMID 7973651.
^ Parker J, Computing with DNA., in EMBO Rep, vol. 4, nº 1, 2003, pp. 7–10, PMID 12524509.
^ Ashish Gehani, Thomas LaBean and John Reif. DNA-Based Cryptography. Proceedings of the 5th DIMACS Workshop on DNA Based Computers, Cambridge, MA, USA, 14–15 June 1999.
^ Russel P. Goodman, Schaap, Iwan A. T.; Tardin, C. F.; Erben, Christof M.; Berry, Richard M.; Schmidt, C.F.; Turberfield, Andrew J., Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication, in Science, vol. 310, nº 5754, 9 dicembre 2005, pp. 1661–1665, Bibcode:2005Sci...310.1661G, DOI:10.1126/science.1120367, PMID 16339440.
^ T. Hodge and M.J.T.V. Cope (2000). "A Myosin Family Tree". Journal of Cell Science 113: 3353-3354 Entrez PubMed 10984423
^ Wray G, Dating branches on the tree of life using DNA, in Genome Biol, vol. 3, nº 1, 2002, pp. REVIEWS0001, PMID 11806830.
^ I Letunic, Interactive Tree Of Life (iTOL): an online tool for phylogenetic tree display and annotation., in Bioinformatics, 23(1), 2007, pp. 127-8.
^ FD Ciccarelli, Toward automatic reconstruction of a highly resolved tree of life., in Science, 311(5765), 2006, pp. 1283-7.
^ Lost Tribes of Israel, NOVA, messa in onda sulla PBS: 22 febbraio 2000. Testo disponibile su PBS.org (ultimo accesso: 4 marzo 2006)
Bibliografia |
- (EN) Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walters, Molecular Biology of the Cell, New York e Londra, Garland Science, 2002, ISBN 0-8153-3218-1.
- (EN) John M. Butler, Forensic DNA Typing, Elsevier, 2001, ISBN 978-0-12-147951-0.
- (EN) Berg J., Tymoczko J., Stryer L., Biochemistry, W. H. Freeman and Company, 2002, ISBN 0-7167-4955-6.
- (EN) Baldi, Pierre. Brunak, Soren, Bioinformatics: The Machine Learning Approach, MIT Press, 2001, ISBN 978-0-262-02506-5.
- Gusfield, Dan. Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press, 15 gennaio 1997. ISBN 978-0-521-58519-4
(EN) location Mount DM, Bioinformatics: Sequence and Genome Analysis, 2ª ed., Cold Spring Harbor Laboratory Press, 2004, ISBN 0-87969-712-1. Più di un parametro tracognomeeautore
- (EN) Andrew Berry; James D. Watson, DNA: the secret of life, New York, Alfred A. Knopf, 2003, ISBN 0-375-41546-7.
- (EN) James D. Watson, DNA: The Secret of Life, Random House, 2004, ISBN 978-0-09-945184-6.
- (EN) Robert Olby, Francis Crick: A Biography, Plainview, N.Y, Cold Spring Harbor Laboratory Press, 2009, ISBN 0-87969-798-9.
- (EN) Gunther Stent; James D. Watson, The Double Helix, New York, Norton, 1980, ISBN 0-393-95075-1.
- John W. Pelley, Biochimica, Elsevier, 2008, ISBN 978-88-214-3020-6.
- Giuliano Ricciotti, Biochimica di base, Zanichelli, 1987, ISBN 88-08-01182-8.
Voci correlate |
- Acido nucleico
- Complementarità
- Computer a DNA
- Conformazioni del DNA
- Cromosoma
- DNA a tripla elica
- DNA clamp
- DNA complementare
- DNA girasi
- DNA metiltransferasi
- DNA mitocondriale
- DNA non codificante
- DNA nucleotidil-esotrasferasi
- DNA polimerasi (DNA-dipendente)
- DNA polimerasi (RNA-dipendente)
- DNA ricombinante in botanica
- DNA ricombinante
- DNA satellite
- DNA-binding protein
- Dogma centrale della biologia molecolare
- Frammentazione del DNA
- Impronta genetica
- Macchina di DNA
- Nanotecnologia del DNA
- Prodotto genico
- Progetto genoma
- RNA
- Sequenza ripetuta di DNA
- Superavvolgimento del DNA
- Tecnologia del DNA ricombinante
- Traduzione (biologia)
- Trascrizione (biologia)
- Virus a DNA
Altri progetti |
Altri progetti
- Wikiquote
- Wikibooks
- Wikizionario
- Wikimedia Commons
 Wikiquote contiene citazioni di o su DNA
Wikiquote contiene citazioni di o su DNA
 Wikibooks contiene testi o manuali su DNA
Wikibooks contiene testi o manuali su DNA
 Wikizionario contiene il lemma di dizionario «DNA»
Wikizionario contiene il lemma di dizionario «DNA»
 Wikimedia Commons contiene immagini o altri file su DNA
Wikimedia Commons contiene immagini o altri file su DNA
Collegamenti esterni |
DNA, su Treccani.it, Istituto dell'Enciclopedia Italiana.
DNA, su thes.bncf.firenze.sbn.it, Biblioteca Nazionale Centrale di Firenze.
(EN) DNA, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) DNA Interactive, su dnai.org.
- DNA, in Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana, 15 marzo 2011.
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | LCCN (EN) sh85037008 · GND (DE) 4070512-2 · BNF (FR) cb119649178 (data) |
|---|

