Carcinoma del polmone

Multi tool use
.mw-parser-output .disclaimer{margin-bottom:.5em;border:1px solid #CCC;padding:2px 4px 3px}.mw-parser-output .disclaimer td:first-child{padding-right:8px}.mw-parser-output .disclaimer td:last-child{width:100%;padding-right:1em}
| Carcinoma del polmone | |
|---|---|
 Sezione di polmone colpito da carcinoma a cellule squamose (area solida biancastra). La zona a valle del bronco colpito ha limiti sfrangiati ed irregolari, con aspetto cotonoso; quest'ultimo reperto identifica un'area di consolidamento pneumonico post-ostruttivo. | |
| Tipo |
Maligno |
Cellula di origine |
Epitelio bronchiale Cellule APUD |
Fattori di rischio |
|
Incidenza |
60-90/100 000 |
| Età media alla diagnosi |
60-80 anni |
| Rapporto M:F |
4-5:1 |
| Classificazione e risorse esterne | |
ICD-9-CM |
(EN) 162 |
ICD-10 |
(EN) C33-C34 |
 Sezione istologica di un carcinoma polmonare a cellule squamose. Il tessuto è composto da cellule squamose e non sono più presenti le caratteristiche della mucosa e della sottomucosa bronchiale normale. | |
Il carcinoma del polmone è una categoria diagnostica che comprende l'insieme delle neoplasie maligne che originano dai tessuti epiteliali (carcinomi) che compongono i bronchi e il parenchima polmonare.[1]
Per questo, i sarcomi e i linfomi che originano nel contesto delle strutture polmonari devono essere distinti da questa categoria.
La maggior parte (oltre il 95%) delle neoplasie polmonari maligne è rappresentato dal carcinoma del polmone, mentre i sarcomi e linfomi costituiscono meno dello 0,5% di questa casistica.[2] Meno del 5% delle neoplasie polmonari è invece rappresentato da tumori benigni (amartoma) o a basso grado di malignità (carcinoidi).[3]
Un'ulteriore distinzione deve essere operata tra neoplasie primitive e neoplasie secondarie; infatti, mentre le prime originano dalle strutture polmonari, le seconde sono rappresentate da metastasi di neoplasie che si originano in altri organi come, ad esempio, il rene, il fegato, la mammella e la prostata.
Indice
1 Storia
2 Epidemiologia
2.1 Nel mondo
2.2 In Europa
2.2.1 Incidenza e mortalità per carcinoma del polmone in Europa (dati)
2.3 In Italia
3 Eziologia
3.1 Fumo di sigaretta
3.2 Radon
3.3 Amianto
3.4 Inquinamento atmosferico
3.5 Virus
3.6 Predisposizione genetica
3.7 Malattie polmonari
4 Patogenesi
4.1 Alterazioni clinico-patologiche
4.2 Eventi biologico-molecolari
4.2.1 Autosufficienza per la crescita cellulare
4.2.1.1 Recettore del fattore di crescita dell'epidermide
4.2.1.2 Ras
4.2.1.3 Myc
4.2.2 Evasione dalla apoptosi
4.2.3 Evasione dal blocco alla crescita cellulare
4.2.4 Insensibilità all'invecchiamento cellulare
4.2.5 Angiogenesi
4.2.6 Invasione e metastatizzazione
5 Anatomia patologica
5.1 Nomenclatura delle neoplasie
5.2 Classificazione istologica
5.3 Aspetto microscopico
5.3.1 Carcinoma squamocellulare
5.3.2 Adenocarcinoma
5.3.3 Carcinoma bronchioloalveolare
5.3.4 Carcinoma polmonare a grandi cellule
5.3.5 Carcinoma polmonare a piccole cellule
5.4 Aspetto macroscopico
5.4.1 Carcinoma squamocellulare
5.4.2 Adenocarcinoma
5.4.3 Carcinoma bronchioloalveolare
5.4.4 Carcinoma polmonare a grandi cellule
5.4.5 Carcinoma polmonare a piccole cellule
6 Profilo clinico
6.1 Crescita locale del tumore
6.2 Invasione e ostruzione delle strutture adiacenti
6.3 Coinvolgimento dei linfonodi regionali
6.4 Presenza di metastasi a distanza
6.5 Sindromi paraneoplastiche
7 Profilo diagnostico
8 Classificazione
8.1 Estensione e localizzazione del tumore - T
8.2 Coinvolgimento linfonodale - N
8.3 Presenza di metastasi - M
9 Terapia
9.1 Chirurgia
9.2 Chemioterapia
9.2.1 Chemioterapia adiuvante per NSCLC
9.3 Radioterapia
9.4 Radiologia interventistica
9.5 Terapia mirata
10 Prognosi
11 Prevenzione
12 Screening
12.1 Metodica TC spirale a basse dosi
12.2 Test del respiro
13 Note
14 Bibliografia
14.1 Oncologia
14.2 Patogenesi e genetica
14.3 Anatomia patologica
14.4 Medicina interna
14.5 Diagnostica per immagini e radioterapia
14.6 Chirurgia
14.7 Terapia farmacologica, Chemioterapia
15 Voci correlate
16 Altri progetti
17 Collegamenti esterni
Storia |
Il carcinoma del polmone era poco comune prima della diffusione del tabagismo e fino al 1791 non era considerato un'entità patologica con dignità propria.[4] I differenti aspetti del carcinoma del polmone vennero descritti nel 1819.[5] Nel 1878 i tumori maligni del polmone costituivano solo l'1% delle neoplasie osservate in corso di autopsia, ma la percentuale salì fino al 10-15% nella prima parte del 1900.[6] I dati riportati nella letteratura medica riferiscono solo 374 casi in tutto il mondo nel 1912,[7] ma lo studio dei dati derivati dai referti autoptici ha dimostrato che l'incidenza aumentò dallo 0,3% nel 1852 al 5,66% nel 1952.[8]
In Germania, nel 1929, il medico Fritz Lickint riconobbe la connessione tra il fumo di sigaretta e il carcinoma del polmone,[6] evento che portò a un'imponente campagna anti-fumo nella Germania nazista.[9] Il British Doctors Study, uno studio iniziatosi negli anni cinquanta, costituì la prima solida evidenza epidemiologica della connessione tra il fumo e il carcinoma del polmone.[10] Come risultato, nel 1964, il chirurgo generale degli Stati Uniti raccomandò a tutti i fumatori di interrompere l'abitudine al fumo.[11]
La connessione con il radon venne riconosciuta per prima tra i minatori delle riserve metallifere intorno a Schneeberg, nella zona di confine tra la Baviera e la Boemia. Questa regione è molto ricca in fluorite, ferro, rame, cobalto e argento, quest'ultimo raccolto fin dal 1470.
La presenza di notevoli quantità di uranio e radio si tradusse in un'intensa e continuativa esposizione al radon, gas radioattivo ritenuto responsabile della carcinogenesi (vedi eziologia).
I minatori svilupparono una quantità sproporzionata di affezioni polmonari, ricondotte nel 1870 ai poliedrici quadri clinici sostenuti dalle neoplasie polmonari. È stato stimato che circa il 75% di questi minatori morirono per carcinoma del polmone.[12] Nonostante questa scoperta l'estrazione di uranio continuò anche durante gli anni cinquanta, a causa della continua richiesta da parte dell'Unione Sovietica.[13]
Il primo intervento riuscito di pneumectomia per carcinoma del polmone è stato effettuato nel 1933.[14] La radioterapia palliativa è stata usata sin dagli anni quaranta,[15] mentre la radioterapia radicale (ad alti dosaggi) cominciò a essere presa in considerazione dagli anni cinquanta in poi come presidio terapeutico nei soggetti con carcinoma del polmone limitato, ma inadatti all'intervento chirurgico.[16] Nel 1997 la radioterapia continua accelerata iperfrazionata (CHART) soppiantò la convenzionale radioterapia radicale per la cura delle neoplasie polmonari.[17]
Per quanto riguarda il carcinoma polmonare a piccole cellule, gli iniziali approcci chirurgici nel 1960[18] e la radioterapia radicale[19] furono infruttuosi. Regimi chemioterapici soddisfacenti vennero sviluppati solo a partire dagli anni settanta.[20]
Epidemiologia |
Nel mondo |

Stime di incidenza e mortalità divise per classe di età per carcinoma del polmone negli Stati Uniti nell'anno 2006
Il carcinoma del polmone è la neoplasia con il maggior tasso di incidenza e di mortalità nel mondo (1,35 milioni di nuovi casi all'anno e 1,18 milioni di morti), con la massima frequenza negli Stati Uniti d'America e in Europa.[21] Negli Stati Uniti, nel 2006, il carcinoma del polmone è stato diagnosticato in circa 60 persone ogni 100 000 abitanti; nello stesso periodo sono morte per questa neoplasia circa 52 persone ogni 100 000 abitanti.[2]
Vengono colpiti prevalentemente soggetti di età superiore a 50 anni che abbiano fatto uso di tabacco. Le misure di prevenzione per il fumo di sigaretta, prese dal 1960 in poi, hanno portato a una lenta ma costante diminuzione del tasso di mortalità negli individui di sesso maschile nella prima parte di questo secolo, benché non si sia ancora osservata una diminuzione significativa nelle donne.[22] In particolare è stato rilevato che, mentre nell'Europa orientale il tasso di mortalità è maggiore negli uomini, nell'Europa settentrionale (vedi epidemiologia in Europa) e negli Stati Uniti il tasso di mortalità è maggiore nelle donne.[23]
Altri studi epidemiologici si sono concentrati nella valutazione di altri fattori di rischio per lo sviluppo di tumori polmonari, rivelando un maggiore tasso d'incidenza nelle popolazioni esposte all'inquinamento proveniente dalle emissioni di automobili, industrie e centrali termoelettriche, come nel Texas,[24] a Taiwan[25] e nelle zone limitrofe a Dublino.[26] Dai dati provenienti da questi studi è risultato evidente il ruolo delle misure preventive focalizzate sulla riduzione dell'esposizione soprattutto ai fumi provenienti dalla combustione dei carburanti derivati dal petrolio.[27]
Il carcinoma del polmone è meno comune nei paesi in via di sviluppo, benché sia stato rilevato un notevole aumento di incidenza e di mortalità nei paesi in cui è subentrata l'abitudine al fumo di sigaretta, in particolare in Cina[28] e in India.[29]
L'incidenza (per ogni paese) di neoplasie polmonari ha una relazione inversa con l'esposizione alla luce solare e ai raggi ultravioletti: una possibile spiegazione del fenomeno può essere connessa al ruolo anti-tumorale svolto dalla vitamina D, che si origina nella pelle in seguito all'esposizione solare.[30]
Un dato degno di nota è un aumento dell'incidenza, dal 1950 in poi, della variante adenocarcinoma,[31] tumore che interessa soprattutto le regioni periferiche del polmone. Il fenomeno è essenzialmente dovuto all'introduzione del filtro nelle sigarette, in grado di intrappolare le particelle più grandi (che si depositerebbero nei bronchi prossimali) e di lasciar passare invece le particelle più piccole, che si depositano nei bronchi distali. La presenza del filtro, inoltre, induce il fumatore a fare inspirazioni più profonde per ricevere la stessa quota di nicotina, con maggiore deposizione delle sostanze tossiche nelle regioni polmonari più periferiche.[32] Negli Stati Uniti d'America, tuttavia, l'incidenza di adenocarcinoma sta diminuendo dal 1999: questo dato sembra essere dovuto alla diminuzione dell'inquinamento ambientale.[31]
In Europa |
| Guida alla lettura dei dati |
|---|
|
In Europa (2006) il carcinoma del polmone costituisce la più comune causa di morte per cancro.[33]
Nella tabella e nelle carte tematiche sono riportati i relativi dati di incidenza e mortalità in Europa nello stesso periodo.[33] L'incidenza nelle femmine, in assoluto, è minore di quella nei maschi, in accordo con la tendenza mondiale. In particolare, l'incidenza nei maschi risulta essere particolarmente elevata negli Stati dell'Europa orientale (Ungheria, Polonia, Russia e Bielorussia), mentre negli Stati dell'Europa settentrionale (Svezia, Finlandia, Norvegia, Gran Bretagna, Islanda e Irlanda) l'incidenza è molto minore. Per le femmine la situazione è quasi opposta: negli Stati dell'Europa settentrionale l'incidenza è massima, con un sorpasso sul sesso maschile in Islanda, mentre è minima nell'Europa orientale.
Elaborando queste informazioni si ricava che l'assetto della distribuzione dell'incidenza prevede una discrepanza minima tra il sesso maschile e quello femminile negli Stati del nord e massima negli Stati dell'est. Allo stesso modo si può constatare che, in linea generale, a mano a mano che per ogni paese scende l'incidenza per i maschi quella per le femmine aumenta fino a equipararsi. La mortalità segue strettamente la tendenza mostrata dall'incidenza, con picchi nei paesi dell'est per i maschi e nei paesi del nord per le femmine.
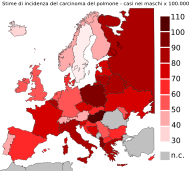
Incidenza nei maschi

Incidenza nelle femmine

Mortalità nei maschi
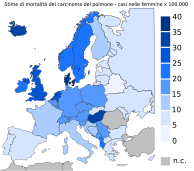
Mortalità nelle femmine
Incidenza e mortalità per carcinoma del polmone in Europa (dati) |
| Nazione | Incidenza nei maschi | Incidenza nelle femmine | Mortalità nei maschi | Mortalità nelle femmine |
|---|---|---|---|---|
| 95 | 26 | 85 | 23 |
|
| 54 | 22 | 51 | 18 |
|
| 93 | 23 | 94 | 21 |
|
| 87 | 7 | 75 | 5 |
|
| 76 | 18 | 70 | 16 |
|
| 67 | 12 | 58 | 9 |
|
| 66 | 10 | 60 | 9 |
|
| 69 | 14 | 81 | 16 |
|
| 65 | 49 | 58 | 42 |
|
| 80 | 13 | 88 | 11 |
|
| 46 | 15 | 44 | 13 |
|
| 76 | 15 | 60 | 14 |
|
| 61 | 21 | 54 | 18 |
|
| 57 | 35 | 51 | 30 |
|
| 89 | 13 | 69 | 11 |
|
| 60 | 34 | 49 | 26 |
|
| 41 | 46 | 40 | 35 |
|
| 85 | 16 | 63 | 14 |
|
| 83 | 10 | 79 | 9 |
|
| 92 | 10 | 74 | 8 |
|
| 70 | 16 | 63 | 17 |
|
| 72 | 9 | 62 | 8 |
|
| 64 | 13 | 50 | 9 |
|
| 54 | 34 | 48 | 26 |
|
| 63 | 33 | 67 | 31 |
|
| 103 | 29 | 92 | 22 |
|
| 45 | 12 | 43 | 8 |
|
| 79 | 23 | 77 | 19 |
|
| 93 | 11 | 75 | 8 |
|
| 72 | 12 | 65 | 12 |
|
| 62 | 17 | 63 | 18 |
|
| 76 | 23 | 69 | 20 |
|
| 68 | 14 | 67 | 9 |
|
| 29 | 24 | 30 | 24 |
|
| 53 | 26 | 43 | 18 |
|
| 75 | 10 | 59 | 7 |
|
| 119 | 42 | 110 | 35 |
In Italia |

Incidenza e mortalità in Italia per carcinoma del polmone nel periodo 1998-2002
In Italia nel 2004 sono morte 32 840 persone per carcinoma del polmone.[34]
Nel periodo compreso tra l'anno 1998 e il 2002, nell'area AIRT (località italiane analizzate nei grafici a destra) il carcinoma del polmone ha rappresentato per frequenza la 3ª neoplasia diagnosticata nel sesso maschile e la 4ª nel sesso femminile.[35] Per quanto riguarda la mortalità, il carcinoma del polmone rappresenta la prima causa di mortalità per cancro nell'uomo e la seconda nella donna (dopo il cancro della mammella).
I tassi relativi sono stati elaborati e inseriti nel grafico a destra, dalla cui osservazione è possibile ricavare una serie di informazioni. In primo luogo, come in Europa, l'incidenza di carcinoma del polmone in Italia è caratterizzata da un rapporto maschi: femmine di circa 5-4:1, benché queste differenze si stiano completamente annullando per quanto riguarda l'incidenza in soggetti di età compresa tra i 20 e i 44 anni.[36]
L'incidenza per il sesso maschile è massima a Genova, in Veneto, a Ferrara e a Napoli, mentre è minima nell'Alto Adige; nelle femmine l'incidenza è massima nel Veneto e a Parma mentre è minima in alcune città del Sud come Salerno e Ragusa. La mortalità per i maschi è massima in Veneto, Napoli e a Varese mentre è minima in Umbria, a Macerata e a Ragusa. Nelle femmine la mortalità è massima a Ferrara e in Veneto mentre è minima a Ragusa, Salerno e Macerata.
Un'ulteriore osservazione può essere fatta confrontando i dati di incidenza con quelli di mortalità per uno stesso luogo, ricavando che, comunque sia, il carcinoma del polmone ha un bassissimo indice di sopravvivenza sia nei maschi sia nelle femmine. Inoltre, per entrambi i sessi, in luoghi come Ferrara e Genova dove è massimo il tasso di incidenza vi è un indice di sopravvivenza maggiore rispetto a luoghi come l'Alto Adige in cui l'incidenza è minima. Questo significa che ad esempio a Genova, benché il tasso di mortalità sia in assoluto maggiore rispetto a quello dell'Alto Adige, vi è una maggiore possibilità di sopravvivenza nei soggetti cui viene diagnosticato il carcinoma del polmone.
Nello stesso periodo gli istotipi (vedi classificazione istologica) più frequenti nel sesso maschile sono il carcinoma polmonare a cellule squamose (32%) e l'adenocarcinoma polmonare (23%), mentre il carcinoma polmonare a piccole cellule rappresenta circa l'8% di questa casistica.[35] Nelle femmine l'adenocarcinoma polmonare rappresenta l'istotipo più frequente (33%), seguito dal carcinoma polmonare a cellule squamose (16%). Come nei maschi, il carcinoma polmonare a piccole cellule è meno frequente a questi due istotipi (9%). In entrambi i sessi l'età media di incidenza in Italia è tra i 70 e gli 80 anni. La mortalità nei maschi è massima tra i 75 e i 79 anni, mentre nelle femmine è massima tra gli 80 e 84 anni. Deve inoltre essere sottolineato che a partire dalla fine degli anni ottanta fino al 2002 l'incidenza e la mortalità di carcinoma del polmone sono diminuite nel sesso maschile. Nel sesso femminile i dati indicano un aumento dell'incidenza e della mortalità. Tuttavia, per il sesso femminile, la mortalità cresce meno di quanto cresca l'incidenza; il motivo di questo fenomeno è da ricercare nella maggiore speranza di sopravvivenza offerta dai nuovi schemi di chirurgia associati a radioterapia e chemioterapia adiuvante (vedi terapia).
Eziologia |
Fumo di sigaretta |

L'incidenza del cancro ai polmoni è strettamente correlata al consumo di sigarette, come attesta il grafico comparativo. Fonte:NIH
Il fumo di sigaretta è considerato il principale agente eziologico per lo sviluppo di carcinoma del polmone.[37] Secondo uno studio elaborato servendosi di proiezioni statistiche, è responsabile di circa il 90% dei tumori polmonari mortali nei paesi sviluppati.[38] In particolare, sempre secondo uno studio, negli USA il fumo di sigaretta è responsabile dello sviluppo dell'87% dei casi di neoplasia polmonare (90% negli individui di sesso maschile e 85% nelle donne),[39] con un'incidenza che aumenta considerevolmente se le prime esposizioni avvengono entro i 25 anni di età.[40] Il fumo di sigaretta contiene circa 60 cancerogeni certi,[41] inclusi i radioisotopi provenienti dal decadimento del radon, il benzopirene e alcune nitrosamine. Inoltre, la nicotina presente è in grado di deprimere la risposta immunitaria, diminuendo la capacità di sorveglianza e di uccisione delle cellule neoplastiche da parte dei linfociti T e dei linfociti NK.[42] Il rischio percentuale di sviluppo di cancro mortale aumenta con l'aumentare del tempo di esposizione e del numero di sigarette fumate, con graduale diminuzione temporale del rischio in seguito a cessazione totale dell'esposizione.[43] Il fumo di sigaretta non rappresenta solo un fattore di rischio, ma anche un importante elemento in grado di influenzare la prognosi, dimostrato dal fatto che soggetti non fumatori ma con carcinoma del polmone hanno una maggiore percentuale di sopravvivenza a 5 anni rispetto ai fumatori.[44] Inoltre è stato ampiamente documentato che la cessazione del fumo in seguito alla diagnosi di tumore migliora notevolmente il profilo prognostico.[45]
Del fumo di sigaretta si deve considerare una componente mainstream e una sidestream; la prima, ad alte temperature, è quella generata da processi di inspirazione attiva. La seconda, a basse temperature, è il risultato della combustione spontanea tra le dita o nel posacenere. Ultimamente questa distinzione ha assunto un notevole peso epidemiologico, poiché recenti studi[46] hanno dimostrato come la componente sidestream, che rappresenta per larga parte il fumo passivo (85%), sia potenzialmente più nociva rispetto alla componente mainstream (fumo attivo). Naturalmente all'atto pratico, data la notevole diluizione nell'aria che il fumo passivo subisce prima di essere eventualmente inalato, l'aumento percentuale di rischio di contrarre patologie a cui è esposto chi lo assume resta notevolmente inferiore rispetto a quello del fumatore attivo. La connessione tra esposizione passiva e aumento del rischio è stata ulteriormente dimostrata da studi condotti negli USA,[22][47] in Europa,[48] in Gran Bretagna[49] e in Australia[50] che hanno documentato un aumento del rischio relativo nei soggetti esposti al fumo passivo (soggetti che vivono o che lavorano con un fumatore attivo).
Radon |
Il radon è un gas inodore e incolore, generato dai processi di decadimento del radio, esso stesso prodotto del decadimento dell'uranio, presente diffusamente nella crosta terrestre (granito e minerali usati per la costruzione delle abitazioni). Il radon rappresenta un elemento volatile e radioattivo, in grado di indurre mutazioni a carico del DNA e di rappresentare quindi un rischio concreto di neoplasia: ricerche recenti (2006) hanno promosso il radon come secondo fattore di rischio per lo sviluppo di cancro mortale al polmone.[51] I livelli di radon variano in base alla località e in base alla composizione relativa della crosta terrestre; per esempio in Cornovaglia l'elevata presenza di granito e altri minerali aumenta a tal punto i livelli di radon da rendere consigliato l'uso di ventilatori ed estrusori per diminuire la concentrazione del gas all'interno degli edifici.[52] La United States Environmental Protection Agency (EPA) ha stimato che negli USA almeno in una casa su 15 sono presenti livelli di radon che superano di almeno 4 picocurie per litro (pCi/L, o 148 Bq/m³) i limiti di sicurezza stabiliti.[53] L'Iowa è lo Stato degli USA con la più elevata concentrazione di radon nell'aria (superiore di quattro pCi/L rispetto al controllo), con un aumento del rischio di sviluppo di cancro mortale del polmone superiore del 50% rispetto alla popolazione non esposta.[54] L'esposizione media italiana al radon all'interno degli edifici è mediamente di 77 Bq/m³; in relazione alla mortalità assoluta per cancro al polmone è stato stimato che dal 5 al 20% di insorgenza di tumore mortale è dovuta a tale esposizione.[55] In base a questi dati e a successivi esperimenti, una buona ventilazione degli edifici si è dimostrata essere un provvedimento in grado di diminuire considerevolmente l'esposizione al radon.[56] I decreti legislativi n. 230/1995 e n. 241/2000 impongono inoltre la misurazione dei livelli di radiazione assunta da radon negli individui che lavorano nel sottosuolo.[57]
Amianto |
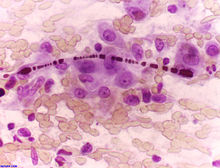
Fibre di asbesto (corpo aghiforme circondato da inclusioni rotondeggianti marroni) in aspirato citologico svolto per la diagnosi di tumore polmonare
L'amianto, oltre a essere implicato nella patogenesi della asbestosi e del mesotelioma pleurico, mostra un ruolo sinergico con il fumo di tabacco per lo sviluppo di carcinoma del polmone.[58] In Gran Bretagna è stato stimato che il 2-3% dei casi di cancro mortale è causato dall'amianto.[59] In Italia, l'amianto è stato messo al bando a partire dal 1992, con la legge n. 257. Uno stesso studio ha dimostrato che mentre la sola esposizione all'amianto è in grado di aumentare il rischio di 5 volte, l'esposizione combinata di amianto e fumo di tabacco è in grado di aumentare il rischio di 50 volte.[60]
Inquinamento atmosferico |
Benché non siano presenti ancora dati definitivi, l'esposizione allo smog e all'inquinamento atmosferico (prodotti della combustione dei derivati del petrolio e prodotti delle lavorazioni che comportano l'uso di metalli particolari come nichel e cromo) è chiamata in causa nella patogenesi di cancro mortale del polmone.[61][62]
Virus |
La capacità oncogena dei virus è stata ampiamente dimostrata nel modello animale,[63][64] benché recenti evidenze suggeriscano il ruolo potenziale del papillomavirus,[65] del poliomavirus JC,[66] del simian virus 40 (SV40), del virus BK e del citomegalovirus[67] nella patogenesi del carcinoma del polmone nell'uomo. Questi virus possono alterare il ciclo cellulare e bloccare i processi di apoptosi, promuovendo un anomalo controllo della replicazione cellulare e il successivo sviluppo di neoplasia.
Predisposizione genetica |
La presenza di anomalie ereditarie a carico di p53 (come la sindrome di Li-Fraumeni) e di Rb predispongono al carcinoma del polmone.[68] Un ulteriore gene coinvolto sembra essere il gene che codifica per il citocromo CYP1A1, della famiglia del sistema enzimatico P450,[69] responsabile del metabolismo di alcuni farmaci, di composti aromatici e del benzopirene.[70] Polimorfismi a carico di questo gene comportano un alterato metabolismo dei composti cancerogeni presenti nel fumo di sigaretta, con maggiore suscettibilità al cancro per i soggetti che hanno ereditato la variante enzimatica del CYP1A1.[3]
Malattie polmonari |
La presenza di enfisema o di bronchite cronica testimonia l'esposizione massiccia al fumo di sigaretta;[71] conseguentemente, questi soggetti hanno una probabilità maggiore di sviluppo di cancro mortale del polmone.[37] Una pregressa tubercolosi rappresenta un rischio a sé stante per lo sviluppo di cancro mortale del polmone; tale evento prende il nome di carcinoma su cicatrice,[72] che descrive l'innesco del processo neoplasico nel sito polmonare nel quale è avvenuto (e in seguito risolto con cicatrizzazione) il processo tubercolare.
Patogenesi |
Gli elementi eziologici analizzati portano a mutazioni del DNA che innescano un insieme di modificazioni che hanno come risultato finale un'intensa proliferazione dell'epitelio, con aberrazioni dell'architettura del tessuto polmonare. Con il tempo e con il prolungarsi dell'esposizione, l'insieme di queste modificazioni costituisce il terreno sul quale origina e si muove la neoplasia. Da queste considerazioni si deduce che al disordine neoplastico si associano alterazioni microscopiche, macroscopiche e molecolari, che evolvono in coerenza nel tempo e nello spazio.
Mentre queste ultime verranno discusse nelle sezione Eventi biologico-molecolari, le prime due corrispondono ad alterazioni visibili che sostengono il quadro clinico-patologico. Occorre quindi considerare sempre che, simultaneamente al disordine neoplastico visibile, si muove un substrato molecolare sincrono ed evolutivo in grado di condizionare la storia clinica e la prognosi del tumore, conferendo proprietà di invasività, metastatizzazione o resistenza alla chemio-radioterapia.
Alterazioni clinico-patologiche |
Alterazioni istologiche nel carcinoma del polmone[3] | |
Tappe anatomo-patogenetiche | |
Stimolo oncogeno ↓ |
Stimolo oncogeno I I I ↓ Iperplasia adenomatosa atipica I I I I ↓ |
Alterazioni reversibili | |
Iperplasia epiteliale ↓ Epitelio metaplastico ↓ | |
Alterazioni irreversibili | |
Displasia ↓ Carcinoma in situ ↓ | |
| Carcinoma polmonare a cellule squamose | Adenocarcinoma polmonare Carcinoma bronchioloalveolare |
Come illustra lo schema, un tumore non insorge in un epitelio sano: occorrono infatti molti anni affinché lo stimolo cancerogeno, rappresentato dal contatto con uno dei fattori di rischio, possa promuovere alterazioni tali da innescare lo sviluppo di tumore. Nell'epitelio bronchiale, l'esposizione ripetitiva al fumo porta a un'intensa proliferazione (iperplasia), che tuttavia non possiede le alterazioni genetiche tipiche del tumore. Con il tempo e il perdurare dello stimolo, le cellule che costituiscono il tessuto iperplastico possono andare incontro a un processo definito metaplasia, un particolare evento caratterizzato dalla trasformazione di un tipo cellulare in un altro. Nel caso del polmone, le cellule che compongono l'epitelio si trasformano da cilindriche a fusate, assumendo un aspetto pavimentoso stratificato (metaplasia squamosa).[3] Il passo successivo è rappresentato dalla displasia, una situazione nella quale viene a essere alterata la normale architettura tissutale. Questo significa che le cellule vanno incontro a una proliferazione non più ordinata in base alla fisiologica anatomia del tessuto, ma verranno a svilupparsi, ad esempio, in contesti di pertinenza di altri tessuti. Nel polmone questo è visibile, poiché le cellule pavimentose non si disporranno più verso il lume del bronco, ma tenderanno ad accumularsi negli strati medi e inferiori della mucosa, testimoniando che le cellule alterate sono svincolate dalla polarizzazione imposta dall'epitelio stesso. Differentemente dalla metaplasia, che può essere risolta eliminando lo stimolo nocivo, la displasia è un processo irreversibile e rappresenta il seme dal quale si genera il carcinoma in situ, definito come una lesione neoplastica che non ha ancora oltrepassato il limite imposto dalla membrana basale. Questi eventi descrivono le tappe patogenetiche che caratterizzano la genesi del carcinoma polmonare a cellule squamose; tuttavia è stato messo in evidenza che,[73] a differenza di questo tipo, l'adenocarcinoma polmonare e il carcinoma bronchioloalveolare originano da un'alterazione pre-neoplastica denominata iperplasia adenomatosa atipica, caratterizzata da un'intensa proliferazione di strutture ghiandolari nel contesto del tessuto polmonare.
Eventi biologico-molecolari |
.mw-parser-output .vedi-anche{border:1px solid #CCC;font-size:95%;margin-bottom:.5em}.mw-parser-output .vedi-anche td:first-child{padding:0 .5em}.mw-parser-output .vedi-anche td:last-child{width:100%}
Il terreno attraverso il quale si snoda il disordine neoplastico è caratterizzato da alterazioni molecolari che possono essere riassunte in sei grandi gruppi patogenetici.[74]
Autosufficienza per la crescita cellulare |

Segnalazione intracellullare innescata dal legame tra EGFR e il suo agonista. L'iperespressione di EGFR o la sua mutazione attivante è un importante fattore patogenetico per il carcinoma del polmone
Una cellula privata di fattori di crescita va rapidamente incontro ad apoptosi. Per questo, acquisire autosufficienza per i fattori di crescita rappresenta un meccanismo fondamentale per innescare e sostenere la carcinogenesi. Diverse alterazioni, su diverse componenti, possono realizzare e promuovere l'autosufficienza: per il carcinoma del polmone assumono particolarmente importanza le vie di segnalazione cellulare che riguardano tre sistemi proteici: EGFR, Ras e Myc.
Recettore del fattore di crescita dell'epidermide |
Nel tessuto polmonare uno dei recettori per i fattori di crescita è rappresentato dal recettore del fattore di crescita dell'epidermide o EGFR (anche detto ErbB-1), proteina posta sulla membrana cellulare di molte cellule bronchiali.[75]
Essenzialmente, sono 3 i meccanismi attraverso i quali alterazioni di EGFR possono contribuire allo sviluppo e al mantenimento del carcinoma del polmone.[75]
- Iperespressione dei ligandi di EGFR
- La continua presenza di molecole in grado di stimolare EGFR, benché non sia sufficiente a innescare il processo di carcinogenesi,[76] è estremamente importante poiché porta a una condizione perpetua di stimolo proliferativo.
- Amplificazione di EGFR
- Se il numero di recettori per unità di superficie cellulare aumenta, aumenta di conseguenza la responsività della cellula a un dato stimolo esterno.[76] Le cellule neoplastiche che possiedono più copie del gene di EGFR o un gene costituitavamente espresso, esprimendo un maggior numero di recettori, hanno maggiore capacità proliferativa.
- Mutazioni attivanti di EGFR
- Le mutazioni del gene di EGFR possono portare all'indipendenza funzionale del recettore, rendendolo costitutivamente attivo anche in assenza di ligando.[76] Tali mutazioni sono presenti nel 20% dei NSCLC (Carcinoma polmonare non a piccole cellule; vedi il paragrafo classificazione istologica) e nell'80% di NSCLC non responsivi a terapia,[77] con maggiore frequenza nell'adenocarcinoma polmonare, nel sesso femminile e nei soggetti di origine asiatica.[78]
Ras |
La proteina Ras rappresenta un punto di snodo cruciale nella segnalazione di proliferazione e differenziazione cellulare, anche per quanto riguarda la via trasduzionale di EGFR.[79] Mutazioni di Ras, in particolare dell'isoforma K-Ras, sono presenti soprattutto nell'adenocarcinoma polmonare,[80] benché, comunque sia, rappresentino un'alterazione tipica (15-20%) di tutte le forme di NSCLC.[81] Mutazioni attivanti di K-Ras si associano molto strettamente all'abitudine al fumo di sigaretta e alla resistenza insorta durante il trattamento chemioterapico.[82]
Myc |
Myc è un oncogene codificante per una proteina che rappresenta il traguardo finale del segnale di proliferazione convogliato da Ras;[83] ciò significa che una mutazione attivante di Myc, o una sua iperespressione, mima fisiologicamente una mutazione attivante di Ras. Le alterazioni di Myc sono associate a moltissime forme di cancro[84] e nel carcinoma del polmone assumono una valenza particolare le forme cMYC, MYCN e MYCL. Mentre si ha mutazione di cMyc in circa l'8-20% delle forme di NSCLS, la mutazione delle ultime due forme rappresenta un meccanismo patogenetico fondamentale nello sviluppo di carcinoma polmonare a piccole cellule.[85]
Evasione dalla apoptosi |
L'apoptosi, o morte cellulare programmata, rappresenta un processo fisiologico di notevolissima importanza. La sua regolazione permette il corretto sviluppo di diversi nuovi tessuti, a scapito di popolazioni cellulari senescenti o rudimentali. Benché questi processi siano particolarmente evidenti durante l'embriogenesi, l'apoptosi riveste un ruolo fondamentale anche nell'individuo adulto, soprattutto nell'eliminazione dei linfociti autoreattivi e delle cellule tumorali.[86] Giocoforza, la compromissione di tali meccanismi o l'acquisizione da parte del tumore della capacità di evadere l'apoptosi, rappresenta uno dei momenti cruciali per la progressione della neoplasia.[76]
- p53
p53 è un fattore di trascrizione di 53 kDa, codificato dal gene TP53.[87][88][89] L'mRNA che traduce per p53 è trascritto in seguito a danno del genoma, provocato, ad esempio, da radiazioni, agenti chimici e stress ossidativo[90] La proteina p53 così tradotta porta alla trascrizione di p21 (arresto del ciclo cellulare),[91] di Gadd45 (riparazione del DNA)[92][93] e di Bax (induttore dell'apoptosi);[94] riassumendo: un danno al DNA promuove la traduzione di p53 che blocca il ciclo cellulare, ripara il DNA e, in caso di insuccesso, innesca l'apoptosi. Per questo, p53 è stato denominato il guardiano del genoma, in quanto in grado di prevenire l'instaurarsi di danni al DNA e di stabilizzare il genoma.[95]
Mutazioni inattivanti di p53 trasmesse con modalità autosomica recessiva sono le responsabili della sindrome di Li-Fraumeni,[68] che rappresenta una condizione di rischio per lo sviluppo di carcinoma del polmone. Alterazioni di p53 nelle cellule dell'epitelio bronchiale con alterazioni di tipo neoplastico in individui che non hanno ereditato l'allele mutato, sono presenti sia nel carcinoma polmonare a piccole cellule (>90%) sia nei NSCLC (>80%).[1]
- Bcl-2
Bcl-2 è una proteina che si lega alla membrana esterna dei mitocondri inibendo l'apoptosi.[76] Questo significa che un aumento dell'espressione di bcl-2 nelle cellule neoplastiche consente la valicazione degli stimoli apoptotici e la sopravvivenza cellulare. Benché l'iperespressione di bcl-2 rappresenti un punto patogenetico fondamentale nelle varie forme di leucemia e di linfomi, tale alterazione si riscontra frequentemente (>75%) anche nel SCLC.[96] In questo tipo di tumori è sovente riscontrare un'iperespressione di Bcl-2 e una diminuzione funzionale di p53, elementi che, con meccanismo sinergico, sono in grado di promuovere e sostenere l'aggressività del microcitoma.
Evasione dal blocco alla crescita cellulare |
Nel processo di evoluzione di una neoplasia le cellule acquisiscono gradualmente nuove capacità proliferative svincolandosi dal blocco imposto da alcuni geni denominati per questo oncosoppressori.[76] In generale, meccanismi che portano alla perdita di un solo allele oncosoppressore non sono sufficienti a promuovere lo sviluppo di un tumore; tuttavia, la perdita di entrambi gli alleli (two hits hypothesis) è strettamente associata a instabilità genetica, ad alterato ciclo cellulare e, infine, alla proliferazione incontrollata.[97]
La proteina p53 rappresenta un tipico esempio di gene oncosoppressore; un ulteriore classico esempio è rappresentato dalla Rb, in grado di controllare le diverse tappe del ciclo cellulare.[98] Ogniqualvolta uno di questi geni viene perso o inattivato da mutazione in entrambi gli alleli si parla di loss-of-heterozygosity (LOH).[99] Molti studi,[100] focalizzati soprattutto sul carcinoma polmonare a cellule squamose, hanno messo in evidenza le seguenti loss-of-heterozygosity:
|
Studi pubblicati nel marzo 2008[101] hanno messo in luce un ulteriore processo responsabile dell'evasione dal blocco alla crescita cellulare, rappresentato dalla metilazione dei promotori che modulano l'espressione di geni oncosoppressori. La metilazione è un processo fisiologico che porta al silenziamento di geni non necessari per la cellula nel dato periodo preso in considerazione;[102] tuttavia, la metilazione patologica che avviene in queste cellule tumorali può portare al silenziamento di oncosoppressori, con un profilo funzionale conseguente praticamente identico alla loss-of-function. Questi studi hanno inoltre messo in evidenza che tali alterazioni si verificano nelle fasi iniziali del processo di carcinogenesi, quando ancora non sono avvenute alterazioni mutazionali stabili. Ciò implica che le modificazioni a carico delle lesioni neoplastiche precoci possiedono ancora un certo grado di reversibilità.
Insensibilità all'invecchiamento cellulare |

Struttura di un cromosoma umano; i telomeri costituiscono le porzioni terminali bene evidenziate nel disegno. La capacità da parte delle cellule tumorali di contrastare l'accorciamento di queste strutture porta a una spiccata insensibilità all'invecchiamento cellulare
Fisiologicamente, con il ripetersi dei cicli cellulari e, dunque, delle mitosi, i telomeri si accorciano, testimoniando la fisiologica senescenza cellulare.[102] L'enzima telomerasi[103] utilizza continuamente nuovi nucleotidi per cercare di mantenere costante la lunghezza dei telomeri. Da ciò si può dedurre che cellule con una spiccata attività telomerasica, quindi con telomeri costantemente lunghi, possono essere in grado di sfuggire ai normali processi di invecchiamento procedendo verso uno stato di immortalità. Nel carcinoma del polmone è stata ampiamente documentata[104] un'iperattività telomerasica soprattutto nelle fasi precoci del processo neoplastico. Presa visione di questa evidenza, numerosi studi[105][106] si sono focalizzati nel ricercare evidenze che possano suggerire il ruolo dell'esame dell'attività telomerasica sul liquido di lavaggio bronchiolo-alveolare (BAL) prelevato in corso di broncoscopia come misura di screening e prevenzione. Ulteriori studi[107] hanno analizzato la capacità predittiva dell'analisi dell'attività telomerasica associata alla normale citologia dell'espettorato o del BAL. Da queste ricerche risulta che, benché sia ancora una metodica in fase di sperimentazione e con costi elevati, l'analisi dell'attività telomerasica aggiunge sensibilità e accuratezza diagnostica al più specifico esame citologico, con ulteriore migliore capacità discriminativa sul grado di malignità del disordine neoplastico esaminato.
Angiogenesi |

Ricostruzione tridimensionale della struttura del VEGF, il fattore di crescita vascolare responsabile dello sviluppo di vasi sanguigni nel contesto del tessuto tumorale
Numerosi studi sono stati condotti sul ruolo dei fattori di crescita per i vasi sanguigni nel carcinoma del polmone, dimostrando che il fattore cardine è rappresentato dal VEGF;[108] da ciò è stato reso evidente che un'elevata concentrazione di VEGF del sangue dei pazienti con carcinoma del polmone rappresenta un fattore prognostico negativo indipendente dalla loro classificazione.[109] È stato inoltre dimostrato che il processo di angiogenesi sostenuto dal VEGF avviene nelle fasi precoci della carcinogenesi del carcinoma del polmone,[110] con pesanti implicazioni nella storia naturale di queste neoplasie.
Invasione e metastatizzazione |

Ricostruzione tridimensionale della struttura di una E-caderina. Mutazioni a carico di queste proteine svincolano le cellule tumorali dall'inibizione da contatto
Alcuni studi hanno dimostrato che cellule epiteliali bronchiali possono mostrare una perdita dell'inibizione da contatto in seguito a esposizione alla nicotina.[111] Il passo successivo alla perdita dell'inibizione da contatto è rappresentato dall'acquisizione della capacità di invasione tissutale attiva, grazie all'espressione di proteine, come le metallo proteasi, in grado di demolire la matrice extracellulare, permettendo alle cellule neoplastiche di farsi strada tra i tessuti. Molte di queste proteine sono chiamate in causa nella capacità invasiva del carcinoma del polmone; di seguito vengono discussi alcuni degli elementi ritenuti più importanti nell'infiltrazione di questa neoplasia.
- CRMP-1
Collapsin response mediator protein 1 (proteina che media gli effetti delle collapsine) è un gene umano che codifica per una proteina di membrana presente fisiologicamente solo nel tessuto nervoso, dove modula vie di segnalazione importanti nella crescita neuronale durante lo sviluppo del sistema nervoso.[112] Al di là di questo ruolo fisiologico, CRMP-1 è stata indagata in quanto la sua espressione è alterata nelle cellule neoplastiche che possiedono un elevato grado di invasività.[113] Per quanto riguarda il carcinoma del polmone, studi condotti per valutare il ruolo del CTGF (fattore di crescita del tessuto connettivo, che stimola la produzione di matrice extracellulare e di integrine)[114] nella progressione dell'adenocarcinoma polmonare, hanno dimostrato una stretta relazione tra i segnali innescati da CRMP-1[115] e la motilità cellulare, con aumento del grado di invasione e di metastatizzazione. Non solo: dati precedenti a questi studi e basati su una serie di esperimenti condotti con la metodica PCR, northern blot e western blot,[116] hanno dimostrato che cellule metastatiche e con elevato tasso di invasività presentano livelli ridotti di CRMP-1; da ciò è stato ipotizzato che CRMP-1 possa avere un ruolo anti-invasivo fisiologico.

Ricostruzione tridimensionale della catena gamma delle laminine, la cui espressione aberrante nel carcinoma del polmone porta a una intensa capacità invasiva
- Laminina 5
- Le laminine sono proteine della matrice extracellulare, soprattutto dello strato compatto che costituisce la lamina propria che sostiene le cellule epiteliali.[117] Sono formate da trimeri compositi di catene alfa, beta o gamma e le differenti combinazioni caratterizzano le diverse forme di laminine, espresse in differenti tessuti e con funzioni differenti.[118] Infatti, mentre una disfunzione della laminina 2 è responsabile di una forma di distrofia muscolare congenita, la laminina 1 è coinvolta nello sviluppo migratorio delle strutture neuronali, indirizzando, ad esempio, gli assoni delle cellule gangliari retiniche verso le stazioni mesencefaliche. Le laminine rappresentano dunque il terreno nel quale si sviluppano e si muovono le cellule; giocoforza, un'alterazione della produzione delle laminine può portare verso un'alterata architettura tissutale e nel caso di un tumore verso un certo grado di invasività. Alcuni studi hanno identificato nelle alterazioni della laminina 5 una tappa obbligata per l'invasità di molti tipi di tumori, di origine epiteliale e no.[119] Per il ruolo della laminina 5 nel carcinoma del polmone, l'attenzione è stata posta sull'adenocarcinoma polmonare in stadio Ia e Ib; le ricerche hanno dimostrato non solo che una bassa espressione della laminina 5 porta a un grado di invasività minore, ma soprattutto correla con una prognosi a lungo tempo migliore.[120]

Ricostruzione tridimensionale di una delle catene proteiche che compone le integrine, anch'esse chiamate in causa nella capacità invasiva mostrata dalle cellule del tumore polmonare
- Integrine
- Le integrine sono recettori che mediano l'adesione tra le cellule e la matrice extracellulare.[121] In questo senso, sono responsabili della forma e della motilità cellulare, benché possiedano, analogamente a quanto discusso per le caderine, proprietà segnalatorie in grado di influenzare il ciclo cellulare. Nello studio del ruolo delle integrine sullo sviluppo del tumore del polmone sono emersi i seguenti dati:
- L'invasività tissutale del carcinoma polmonare a cellule squamose, dell'adenocarcinoma polmonare, del carcinoma polmonare a grandi cellule e del carcinoma polmonare a piccole cellule dipende strettamente dall'espressione nel microambiente polmonare di un contesto proteico che preveda la presenza di β1 e β3 integrine.[122]
- L'espressione di proteine della matrice extracellulare come la β1 integrina è connessa con la resistenza alla chemioterapia e all'apoptosi mostrata in vivo dal carcinoma polmonare a piccole cellule.[123]
- È stato dimostrato che alcuni fattori di crescita come il TGF-β stimolano la produzione di integrine, promuovendo invasività e metastatizzazione delle cellule neoplastiche. In base a queste evidenze si stanno cercando nuovi farmaci in grado di bloccare questo processo.[124]
- Studi pubblicati nel giugno 2009 hanno dimostrato che la presenza di complessi recettoriali iperespressi formati da integrina β1 sia una condicio sine qua non affinché un carcinoma del polmone possa dar origine ai primi focolai metastatici.[125]
- L'invasività tissutale del carcinoma polmonare a cellule squamose, dell'adenocarcinoma polmonare, del carcinoma polmonare a grandi cellule e del carcinoma polmonare a piccole cellule dipende strettamente dall'espressione nel microambiente polmonare di un contesto proteico che preveda la presenza di β1 e β3 integrine.[122]
Anatomia patologica |
L'esposizione ai fattori di rischio si traduce in modificazioni delle cellule dell'epitelio dei bronchi, soprattutto di quelli di primo, secondo e terzo ordine, da dove origina la maggior parte dei tumori polmonari.[3] Di questi, la maggioranza (90-95%) è rappresentata da tumori maligni di origine epiteliale (carcinomi) mentre solo il 5% dai carcinoidi bronchiali e il 2-5% da tumori mesenchimali[126]. Come discusso in seguito, le forme epiteliali si distinguono in "tumori a piccole cellule" (SCLC) e "tumori non a piccole cellule" (NSCLC). Nelle fasi avanzate anche l'intero polmone può essere invaso dalla massa tumorale e spesso si hanno metastasi ai linfonodi mediastinici che drenano il parenchima polmonare, con aspetto di ilo globoso o comunque aumentato di volume nei radiogrammi del torace. Talvolta i linfonodi aumentati di volume possono comprimere la vena cava superiore determinando una stasi venosa con edema a mantellina (sindrome della vena cava superiore). Sedi frequenti di lesioni metastatiche da carcinoma polmonare sono le ghiandole surrenali, le ossa, il cervello ed eventualmente anche il polmone controlaterale rendendo difficile l'individuazione della sede d'origine.[127] Un tumore polmonare periferico, inoltre, può invadere la pleura per contiguità, causando versamento, le costole o, nel caso di tumori apicali (tumore di Pancoast), i rami del plesso brachiale, causando dolore all'arto superiore corrispondente e particolari sindromi connesse all'interessamento dei plessi nervosi che regolano il sistema nervoso autonomo.[127]
Nomenclatura delle neoplasie |
I nomi delle neoplasie benigne derivano dal nome della cellula di origine al quale si aggiunge il suffisso -oma. Ad esempio, una neoplasia benigna che origina dal tessuto adiposo, è chiamata lipoma (dal greco lypos, grasso). Analogamente, la neoplasia benigna del tessuto cartilagineo è chiamata condroma (dal greco khondrós, cartilagine). Ancora; una neoplasia benigna che origina dai fibroblasti è chiamata fibroma, uno che origina dall'osso si chiama invece osteoma. Adenoma è invece il termine utilizzato per indicare una neoplasia benigna che origina da un epitelio e che riproduce un aspetto ghiandolare. Per le neoplasie maligne la regola è diversa; si deve aggiungere il suffisso -sarcoma se la neoplasia origina da cellule mesenchimali, mentre si usa il suffisso -carcinoma se la neoplasia origina dalle cellule epiteliali. Per cui, una neoplasia maligna dei tessuti precedentemente citati avrà come nome: liposarcoma, condrosarcoma, fibrosarcoma, osteosarcoma e adenocarcinoma. Il 95% delle neoplasie polmonari è maligno e origina dalle cellule dell'epitelio bronchiale. I carcinomi polmonari possono essere ulteriormente divisi in base alle caratteristiche. Ad esempio:
Carcinoma polmonare a cellule squamose: neoplasia maligna che origina dalle cellule che compongono l'epitelio bronchiale ed è caratterizzato dalla presenza di cellule squamose.
Adenocarcinoma polmonare: neoplasia maligna che origina dalle cellule che compongono l'epitelio bronchiale e caratterizzata da un aspetto ghiandolare (acini e papille).
Infine, nel polmone possono insorgere particolari neoplasie a basso grado di malignità (ma non benigne) che originano dalle cellule neuroendocrine e che vengono definiti carcinoidi. Queste neoplasie (rare) devono essere distinte dal carcinoma polmonare a piccole cellule che, pur originando dalle cellule neuroendocrine, è caratterizzato da notevolissima malignità.
Classificazione istologica |
| Classificazione istologica |
Frequenza (%) |
|---|---|
| Carcinoma polmonare non a piccole cellule (NSCLC) |
80.4 |
Carcinoma polmonare a piccole cellule (SCLC) |
16.8 |
Carcinoide[129] |
0.8 |
Sarcoma[130] |
0.1 |
| Altri istotipi |
1.9 |
| Sottotipi istologici di NSCLC |
Frequenza di NSCLC (%) |
||
|---|---|---|---|
| Fumatori |
Non fumatori |
||
Carcinoma a cellule squamose (carcinoma epidermoide) |
42 |
33 |
|
Adenocarcinoma |
Adenocarcinoma (non altrimenti specificato) |
39 |
35 |
Carcinoma bronchioloalveolare |
4 |
10 |
|
Carcinoide |
7 |
16 |
|
| Altri |
8 |
6 |
|
L'Organizzazione mondiale della sanità prevede la divisione in quattro principali tipi istologici; tuttavia, ai fini terapeutici e prognostici è opportuno dividere le neoplasie polmonari in due grandi gruppi,[1] definiti come carcinomi polmonari non a piccole cellule (NSCLC) e carcinoma polmonare a piccole cellule (SCLC).
All'interno degli NSCLC si possono distinguere diversi sottotipi istologici, tra i quali:
Carcinoma polmonare a cellule squamose o carcinoma squamoso o carcinoma epidermoide- Adenocarcinoma polmonare
Carcinoma bronchioloalveolare, talvolta considerato come ulteriore sottotipo dell'adenocarcinoma bronchiale- Carcinoma polmonare a grandi cellule
Il carcinoma epidermoide è un tumore maligno prevalentemente centrale che origina della cellule basali dell'epitelio dei bronchi, con lenta crescita e che predilige i lobi polmonari superiori; è la forma più strettamente associata al fumo di sigaretta.[132] L'adenocarcinoma del polmone è una forma tumorale estremamente variabile con linfotropismo estremamente marcato e in grado di formare metastasi linfonodali senza ingrandimento TC visibile (micrometastasi).[133] Il carcinoma bronchioloalveolare nasce dagli alveoli e diffonde tappezzando la parete alveolare, risultando non strettamente invasivo; ha un decorso clinico indolente e una frequenza molto bassa, con un quadro radiologico simile alla polmonite.
Il carcinoma polmonare a piccole cellule deve essere distinto da queste forme; è un tumore estremamente maligno, con elevatissima mortalità e che si sviluppa in un contesto patogenetico molecolare differente rispetto ai NSCLC; può essere definito come l'estremo maligno della linea dei tumori che originano dalle cellule neuroendocrine (carcinoidi tipici e atipici, carcinoma polmonare a grandi cellule). La malignità tipica di questi tumori viene giustificata dal decorso clinico estremamente rapido, dalla precocissima capacità di metastatizzare e all'associazione con sindromi paraneoplastiche.[127]
Aspetto microscopico |
L'epitelio bronchiale normale è formato da un monostrato di cellule cilindriche ciliate frammiste a cellule mucipare caliciformi. Mentre queste ultime, insieme con le ghiandole della sottomucosa, sono deputate alla produzione di muco, le prime devono sostenere un'intensa attività di pulizia (clearance) dell'epitelio stesso, trasportando il muco prodotto verso l'alto attraverso il movimento ritmato delle ciglia. Tra queste cellule si interpongono le cellule neuroendocrine, in grado di secernere un insieme di sostanze con proprietà vasoattive e con attività sulla muscolatura liscia bronchiale[134]. Sono inoltre presenti cellule indifferenziate che forniscono popolazioni cellulari sempre nuove all'epitelio bronchiale. Mentre si ritiene che i NSCLC originino dalle cellule ciliate o dalle cellule indifferenziate, la presenza di marcatori neuroendocrini nelle cellule degli SCLC fa ritenere che questa linea di tumori originino dalle cellule del sistema APUD.[135]
- Immagini istologiche

Immagine istologica A
Carcinoma squamocellulare: sono presenti cellule con citoplasma intensamente eosinofilo dalla quali protrudono spine che le mettono in contatto con altre cellule. In alto a destra è inoltre possibile osservare la presenza di notevole cheratinizzazione.

Immagine istologica B
Adenocarcinoma a cellule chiare: le strutture cellulari si organizzano formando aggregati pseudo-ghiandolari. Le cellule appaiono chiare per la notevole presenza di muco.

Immagine istologica C1
Carcinoma bronchioloalveolare: le cellule neoplastiche tappezzano i setti interalveolari rispettandone la struttura.
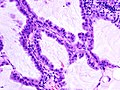
Immagine istologica C2
Carcinoma bronchioloalveolare: ulteriore immagine istologica.

Immagine istologica D
Carcinoma polmonare a grandi cellule': sono presenti notevoli atipie nucleari, nucleolari e citoplasmatiche che rendono il quadro istologico notevolmente pleomorfo. Il nome dato alla neoplasia è giustificato dalla presenza di elementi cellulari giganti.

Immagine istologica E1
Carcinoma polmonare a piccole cellule: le cellule con nucleo intensamente cromofilo e scarso citoplasma si accrescono assumendo una struttura compatta e dall'aspetto organoide.
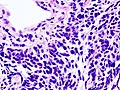
Immagine istologica E2
Carcinoma polmonare a piccole cellule: ulteriore immagine istologica.
- Rappresentazioni
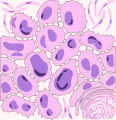
Rappresentazione A
Carcinoma squamocellulare: sono presenti numerose spine tra cellula e cellula. Una perla cornea è parzialmente rappresentata nell'angolo in basso a destra.

Rappresentazione B
Adenocarcinoma: la presenza di strutture ghiandolari più o meno differenziate testimonia la natura della neoformazione.
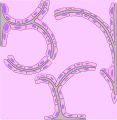
Rappresentazione C
Carcinoma bronchioloalveolare: le cellule neoplastiche si accrescono tappezzando gli alveoli senza provocarne la distruzione.

Rappresentazione D
Carcinoma polmonare a grandi cellule: il quadro è dominato da pleomorfismo marcato, con elementi cellulari giganti frammisti a cellule immature, con nucleoli prominenti e formazioni nucleari aberranti.

Rappresentazione E
Carcinoma polmonare a piccole cellule: si può notare la scarsità del citoplasma e la presenza di nucleo intensamente cromofili. Le cellule si organizzano formando strutture compatte, dall'aspetto a palizzata.
Carcinoma squamocellulare |
Come tutti i carcinomi a cellule squamose (o spinocellulari), questi tumori sono caratterizzati dalla presenza di cheratinizzazione, ben visibile per la presenza di elementi cellulari fusiformi intensamente eosinofili e totalmente o quasi totalmente privi di nucleo.[135] La combinazione e l'intensa proliferazione di questi elementi intorno a un punto porta alla formazione di perle cornee, identificabili come zone concentriche con elevatissima cheratinizzazione (rappresentazione A, in basso a destra). Nell'immagine istologica A (e nella rappresentazione connessa) è inoltre possibile osservare la presenza di "spine" che protrudono dalla membrana cellulare e che formano ponti tra cellula e cellula. I ponti intercellulari altro non sono che desmosomi e testimoniano, unitamente alla cheratinizzazione, la conversione dell'epitelio cilindrico bronchiale in un epitelio molto più simile a quello della cute. La presenza di spine intercellulari è un reperto così caratteristico da poter render necessaria la sua ricerca in ogni lesione bronchiale sospetta. La presenza di perle, di elementi squamosi e di spine delineano una forma di neoplasia ben differenziata; viceversa, l'assenza di perle cornee, la presenza di figure mitotiche atipiche e di elementi cellulari giganti e immaturi possono far propendere più verso un reperto di neoplasia scarsamente differenziata, con un grado maggiore di invasività.[3]
Adenocarcinoma |
Con il termine adenocarcinoma si fa riferimento a una neoplasia di origine epiteliale in cui è possibile osservare un certo grado di differenziazione verso l'epitelio ghiandolare, caratterizzato dalla presenza di strutture acinose o papillari e dalla produzione di mucina.[3] Come mostra l'immagine istologica B, le cellule che si radunano a formare una struttura ghiandolare possono assumere una colorazione molto chiara per l'elevata presenza di mucina nel citosol. In questo caso si può parlare di adenocarcinoma a cellule chiare.[135] Invece, nella rappresentazione B si focalizza l'attenzione sulla formazione di strutture ghiandolari acinose che testimoniano il buon grado di differenziano del tumore; viceversa, ma mano che il tumore diventa più indifferenziato, le strutture acinari possono lasciare il posto a strutture papillari, che danno un aspetto più compatto al tessuto osservato. Con la progressiva perdita della differenziazione il tumore può assumere un aspetto solido, con elementi cellulari atipici e pleomorfi, di difficile caratterizzazione e inquadramento.
Carcinoma bronchioloalveolare |
Questa variante istologica è sovente considerata una variante dell'adenocarcinoma, benché mostri una caratterizzazione anatomo-patologica, diagnostica e prognostica differente. Come è possibile vedere nelle immagini istologiche C1 e C2 e dalla rappresentazione C, le cellule tumorali proliferano rispettando la struttura microscopica polmonare, non invadendo la sottomucosa ma tappezzando come farfalle su di uno steccato (crescita lepidica, dal gr. λεπίς, -ίδος, «involucro», essendo la crescita di questo tumore contenuta all'interno delle vie aeree che appunto lo rivestono) i setti alveolari. Le due varianti, muciparo e non muciparo, si differenziano per forma cellulare ed evoluzione: mentre la prima è costituita da cellule cilindriche e tende a diffondersi per via aerogena, la seconda è caratterizzata da cellule cuboidi o leggermente fusate, in grado di formare noduli spesso confinati.[3]
Carcinoma polmonare a grandi cellule |
Con questo termine si definisce una neoplasia polmonare altrimenti non identificabile nell'ambito di carcinoma squamocellulare o adenocarcinoma. Come suggeriscono sia la rappresentazione sia l'immagine istologica D, questo tipo di tumore è formato da elementi cellulari pleomorfi, con nuclei prominenti e di dimensioni variabili dove è possibile apprezzare nucleoli intensamente cromofili. Questi tumori possono mostrare un certo grado di differenziazione neuroendocrina, confermata dall'aspetto di crescita organoide, con formazione di trabecole e rosette molto simili a quelle osservate nel microcitoma.[136]
Carcinoma polmonare a piccole cellule |
Questo tumore rappresenta l'estremo maligno di una serie di neoplasie che originano dalle cellule neuroendocrine, proprietà confermata dalla presenza di marcatori come la cromogranina o la sinaptofisina. Le cellule sono rotondeggianti, con scarso citoplasma e membrana cellulare ben definita; si organizzano formando strutture a palizzata (immagine istologica e rappresentazione E) con zone di necrosi e con elevatissima conta mitotica, fattore che testimonia il basso grado di differenziazione e l'elevata malignità.[3]
Aspetto macroscopico |

Immagine A1
Carcinoma squamocellulare, con caratteristica presentazione nelle zone centrali del polmone.

Immagine A2
Carcinoma squamocellulare; il tumore si presenta come un'escrescenza verrucosa (a sinistra) occludende il bronco (destra) che si presenta eritematoso e contenente muco.

Immagine A3
Carcinoma squamocellulare: formazione nodulare grigiastra che comprime un bronco di grosso calibro. A valle, è presente un'area di addensamento (zona bianca, cotonosa) che testimonia la presenza di un processo di polmonite ostruttiva.

Immagine B
Adenocarcinoma polmonare: grande massa periferica, lobulata e dall'aspetto traslucido.

Immagine C
Carcinoma bronchioloalveolare: estese nodulazioni frammiste ad aree necrotico-emorragiche che alterano l'architettura polmonare.

Immagine D
Carcinoma polmonare a grandi cellule: estesa massa lobulata bianca e solida che presenta aree di necrosi focale. Il carcinoma si espande fino all'ilo polmonare dove sono inoltre presente linfonodi metastatici.

Immagine E
Carcinoma polmonare a piccole cellule: massa biancastra cotonosa che avvolge un bronco di grosso calibro (sede ilare), infiltrando il tessuto peri-vascolare e intaccando i linfonodi ilari.
In generale il carcinoma del polmone appare come una massa compatta, di colore spesso grigio-biancastro e con contorni sfrangiati e invasivi delle zone circostanti ancora sane del polmone, benché possano essere evidenziate caratteristiche individuali per ogni tipo istologico. Dal luogo d'origine, le cellule tumorali possono migrare per la via linfatica ed ematica in altri organi dove attecchiscono e colonizzano in forma di aggregati detti "metastasi". Frequenti sono le metastasi alle linfoghiandole dell'ilo polmonare, del mediastino, del collo, oppure degli organi, come il surrene, il cervello, le ossa, il fegato o il rene. Le cellule tumorali possono raramente migrare anche nei bronchi e da qui diffondersi in altre regioni polmonari (metastasi polmonari). Le neoplasie possono estendersi localmente e interessare la pleura, producendo un liquido siero-ematico, e la parete toracica o il mediastino.
Carcinoma squamocellulare |
Sono molto spesso tumori centrali[135] (immagine A1). Il carcinoma a cellule squamose si origina dall'epitelio bronchiale come un'escrescenza verrucosa (immagine A2) che può crescere fino a occupare l'intero lume, provocando fenomeni di atelectasia o polmonite post-ostruttive, ben visibile nella figura A3. Il tumore può infiltrare la sottomucosa ed espandersi seguendo il tessuto peribronchiale in direzione mediastinica, dove appare radiograficamente come un'estesa opacità in sede para-ilare (vicino all'ilo polmonare).[137] Si presenta caratteristicamente come una massa "a cavolfiore", lobulata, di colore bianco-grigiastro e di consistenza dura; intorno alla massa possono presentarsi fenomeni necrotici (zone soffici e giallastre) ed emorragici (zone di polmone collassato infarcito di sangue).[3] Talora l'elevato tasso di crescita produce delle zone ischemico-necrotiche nella zona centrale, che può escavarsi raccogliendo materiale purulento; in questi casi si parla di cancro-ascesso.
Adenocarcinoma |
Sono spesso tumori che originano dai bronchi di piccolo calibro, benché possano anche presentarsi in sede parailare.[136] Assumono un aspetto lobulato e traslucido, in virtù della intensa produzione di mucina, come mostra l'immagine B.
Carcinoma bronchioloalveolare |
La confluenza di più noduli (ben visibili nell'immagine C) porta alla formazione di un addensamento talmente esteso da poter essere confuso con una polmonite lobare. Qualora sia presente un'intensa secrezione mucosa, la superficie di taglio può mostrarsi lucida, con aree più o meno grandi di raccolta.[135] L'addensamento del parenchima, senza coinvolgimento bronchiale, porta allo sviluppo di broncogramma nei reperti radiografici, caratterizzato dalla visibilità delle strutture bronchiali contenenti aria nel contesto del mezzo solido rappresentato dal tumore.[133]
Carcinoma polmonare a grandi cellule |
Questo tumore si sviluppa soprattutto nelle zone polmonari periferiche, benché, allo stesso modo dell'adenocarcinoma, possa estendersi in sede parailare.[136] Hanno un aspetto solido e lobulato (immagine D), possono assumere grandi dimensioni e avere aree di raccolta ascessuale al loro interno.
Carcinoma polmonare a piccole cellule |
Si sviluppano in sede ilare, coinvolgendo precocemente le strutture tracheali e mediastiniche.[138] Come mostra l'immagine E, il tumore tende a infiltrare nel tessuto peribronchiale, coinvolgendo anche vasi sanguigni e linfonodi, benché possano presentarsi fenomeni di desquamazione necrotica intrabronchiale nel corso della malattia.[135]
Profilo clinico |
I segni e sintomi che si manifestano nei soggetti con carcinoma del polmone sono direttamente correlati a:
- crescita locale del tumore
- invasione o ostruzione delle strutture adiacenti
- coinvolgimento dei linfonodi regionali
- presenza di metastasi a distanza
- effetto indiretto (sindromi paraneoplastiche)
Crescita locale del tumore |
Come discusso nel profilo anatomo-patologico, i tumori del polmoni possono manifestarsi come forme centrali o come forme periferiche, benché le prime siano le più frequenti. In seguito all'espansione della massa nel lume del bronco viene a crearsi una situazione ostruttiva che si manifesta con sibili e stridori respiratori che possono essere valutati in corso di esame obiettivo, dispnea (spiacevole consapevolezza di respirazione difficoltosa), tosse stizzosa per irritazione della superficie bronchiale ed emoftoe (espettorato striato di sangue) per rottura dei numerosi esili capillari che percorrono la superficie del tumore.[139] Il paziente può lamentare inoltre dolore al torace.
L'ostruzione del lume bronchiale porta a un ristagno delle secrezioni a valle dell'ostruzione, che può esitare verso la polmonite ostruttiva, spesso manifesta con febbre e radiografia compatibile.[140] L'ostruzione completa del lume può portare allo sviluppo di atelectasia (collasso) del parenchima polmonare a valle. Con la crescita, il tumore può andare incontro a escavazione con formazione di cavità ascessuali nel contesto della neoplasia stessa. Tale entità prende il nome di cancro ascesso. Il carcinoma bronchioloalveolare, ricoprendo la superficie degli alveoli, può ostacolare la diffusione dell'ossigeno, causando ipossia e insufficienza respiratoria.[141]
Invasione e ostruzione delle strutture adiacenti |

Plesso brachiale. Un tumore polmonare che si sviluppi nell'apice del polmone, in virtù alla vicinanza alle strutture nervose che decorrono al di sotto della clavicola, può esitare in dolore e disfunzione dell'arto omolaterale
I tumori periferici possono provocare dolore in virtù del possibile coinvolgimento pleurico. Per lo stesso motivo, si può sviluppare un versamento pleurico (e relativa grave dispnea) spesso di carattere essudativo e francamente emorragico.[1] Il coinvolgimento della parete toracica può dar luogo a dispnea in seguito a insufficienza respiratoria di tipo restrittivo. Tumori che originano dalle porzioni superiori del polmone (tumore di Pancoast), possono dar origine a un quadro sindromico definito sindrome di Pancoast o sindrome del tumore del solco superiore, caratterizzato dal coinvolgimento compressivo o infiltrativo dell'ottavo nervo cervicale e del primo-secondo nervo toracico. La sindrome di manifesta con dolore alla spalla che si irradia lungo il lato ulnare dell'arto superiore corrispondente.[142] Il quadro può essere confermato da una radiografia che dimostri l'opacità apicale e l'infiltrazione della prima o seconda costa.[140] Riconosce invece la compressione delle strutture del sistema nervoso simpatico il quadro clinico denominato sindrome di Bernard-Horner, caratterizzato dalla triade miosi (pupilla ristretta), blefaroptosi (palpebra abbassata) ed enoftalmo (occhio infossato) nel lato colpito.[143]
Coinvolgimento dei linfonodi regionali |

Linfonodi mediastinici: essendo localizzati nelle vicinanze di strutture come vena cava superiore, nervi, trachea ed esofago un loro coinvolgimento metastatico può esitare nella compromissione strutturale e funzionale di uno di questi organi
I polmoni sono drenati da una serie di vasi linfatici che fanno capo a numerosi linfonodi del mediastino. Questi vengono divisi in 14 gruppi e sono in contatto con molti organi e strutture mediastiniche. Dunque, la presenza di metastasi linfonodali da carcinoma del polmone, possono presentarsi con segni e sintomi (dovuti alla compressione o all'infiltrazione degli organi confinanti) che nell'insieme vengono considerati con il nome complessivo di sindrome mediastinica. L'infiltrazione dell'esofago da parte dei linfonodi peritracheali può provocare disfagia, con rigurgito e possibile scialorrea, segno che correla con malattia avanzata e prognosi infausta.[144] L'interessamento della trachea o dei bronchi principali può esitare in un quadro dispnoico con tosse irritativa ed emoftoe; analogamente al quadro esofageo, questi segni e sintomi non si manifestano se non in fase tardiva. L'invasione della vena cava superiore è invece molto più frequente, a causa della debolezza tipica di tale struttura:[145] in questo caso la sintomatologia è caratterizzata da edema al volto e agli arti superiori, da obnubilamento, da cefalea e da cianosi dei distretti superiori, in un quadro che viene definito sindrome della vena cava superiore. Un po' meno frequente, ma molto rilevante ai fini prognostici, è il quadro clinico derivante dalla compromissione delle strutture nervose che risiedono nel mediastino. Un incoercibile singhiozzo o una paralisi diaframmatica sono reperti associabili alla compromissione del nervo frenico, mentre una tosse stizzosa e una marcata bradicardia possono associarsi a una lesione del nervo vago. La presenza di metastasi che coinvolgono i linfonodi della finestra aorto-polmonare (compartimento anatomico della porzione sinistra del mediastino compreso tra aorta e arterie polmonari) possono comprimere la prima porzione del nervo ricorrente laringeo di sinistra, con presenza di disfonia per impossibilità dei movimenti di adduzione delle corde vocali (voce rauca).
Presenza di metastasi a distanza |
Il carcinoma del polmone metastatizza al cervello, ai surreni, alle ossa e al fegato. Meno frequentemente, le metastasi possono presentarsi anche nello stesso polmone, nei reni e al pericardio.[146] Le metastasi al cervello possono esordire con sintomi focali, parestesie, scosse cloniche, epilessia o altri disturbi del movimento. Il surrene rappresenta un sito di metastasi specifico per il carcinoma del polmone e per altre poche forme neoplastiche, con effetti metabolici che si contestualizzano in una sindrome di Addison e possono rappresentare un'importante causa di comorbidità. Le metastasi ossee sono associate a un'intensa sintomatologia dolorosa per distensione e infiltrazione del periostio.
Sindromi paraneoplastiche |
Una sindrome paraneoplastica può essere definita come l'insieme dei segni, dei sintomi e delle alterazioni morfologico-funzionali che un tumore è in grado di dare a distanza dalla sede di sviluppo primitivo o di sviluppo delle metastasi.[74] In questo senso, un carcinoma del polmone viene spesso scoperto in seguito all'evidenza clinica di questi quadri patologici.[147] Nel carcinoma del polmone, le sindromi paraneoplastiche di maggiore rilevanza sono la sindrome di Lambert-Eaton (disordine autoimmune caratterizzato da affaticabilità muscolare dovuta dalla presenza di autoanticorpi diretti verso i canali per il calcio voltaggio dipendenti[148]), l'ipercalcemia (dovuta alla produzione da parte del tumore di PTHrP)[149] e la sindrome da inappropriata secrezione di ADH (secrezione da parte del tumore di ormone anti-diuretico).[150] Altri sintomi sistemici che correlano con prognosi infausta sono: artralgie, febbre, anoressia, astenia e insonnia.[144][151]
Profilo diagnostico |
- Radiografie e immagini TC
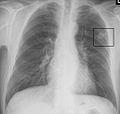
Radiografia del torace che mostra una neoformazione di forma ovalare nella parte periferica del lobo superiore sinistro

Radiografia del torace che mostra opacità compatibili con una neoplasia polmonare e metastasi linfonodali ilari e mediastiniche.
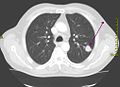
TC del distretto toracico che mostra una massa neoplastica nel polmone sinistro.

Ricostruzione 3D mediante la TC delle strutture toraciche in un soggetto con carcinoma del polmone (freccia) confinato al lobo superiore sinistro.
In un contesto anamnestico in cui si presenta uno o più di questi reperti:[152]
dispnea (spiacevole consapevolezza di respirazione difficoltosa)
emoftoe (espettorato striato di sangue)
tosse cronica e stizzosa
sibili da ostruzione
dolore toracico o dolore addominale
cachessia (perdita di peso), astenia e anoressia
disfonia, con voce rauca
ippocratismo digitale (dita a bacchetta di tamburo e unghie a vetrino d'orologio)
disfagia (difficoltà nella deglutizione)
il primo esame da eseguire è rappresentato dalla radiografia del torace,[133] in grado di dare informazioni sulla presenza di una massa, sul coinvolgimento dei linfonodi mediastinici, sulla presenza di una polmonite ostruttiva o di atelectasia e sulla presenza di versamento pleurico. Qualora le informazioni provenienti dalla radiografia del torace non risultassero esaustive per un soggetto fumatore con emoftoe e tosse, si deve procedere con esami di secondo livello come la tomografia computerizzata o la broncoscopia.[140] Un quadro radiografico compatibile con un tumore polmonare deve essere comunque indagato con la TC,[1] al fine di stabilire un corretto algoritmo diagnostico. Il successivo step è rappresentato dalla biopsia; il prelievo bioptico di una lesione neoplastica confinata nel mantello polmonare (tumore periferico) si svolge attraverso una biopsia percutanea TC guidata. Viceversa, una lesione neoplastica centrale (per definizione raggiungibile con il broncoscopio), deve essere indagata con una biopsia svolta in corso di broncoscopia.[140]
Un ruolo importante è quello dall'analisi citologica dell'espettorato, soprattutto per le forme di tumore centrale; questa analisi, unitamente ad altre procedure come la radiografia del torace in soggetti a rischio (forti fumatori sopra i 50 anni), può avere un ruolo nella diagnosi precoce di carcinoma del polmone.[153]
La diagnosi differenziale si snoda tra i quadri infettivi e i disordini infiammatori cronici in grado di dare una linfoadenopatia mediastinica. Tra i primi è sempre buona regola escludere la tubercolosi come possibile causa di opacità mediastinica; tra i secondi, si deve cercare di escludere la presenza di sarcoidosi.[151] Tuttavia, moltissimi altri quadri infettivi sono in grado di realizzare e sostenere una linfoadenopatia mediastinica. Non si deve inoltre escludere la presenza di disordini linfoproliferativi primitivi del mediastino che solitamente possono provocare opacità ilare senza coinvolgimento polmonare.[154]
Il carcinoma del polmone può essere riscontrato anche in qualità di incidentaloma, ovvero, può essere scoperto grazie a una radiografia del torace svolta per altri motivi.
Il riscontro di tumore primitivo polmonare in seguito a indagini svolte per sospetto di malattia neoplastica estesa (riscontro di metastasi ossee, cerebrali o surrenali), corrisponde a una diagnosi di tumore inoperabile e in fase terminale (grado IV, vedi classificazione) in grado di portare rapidamente verso l'exitus.[127]
Classificazione |
Le forme di carcinoma polmonare a piccole cellule vengono classificate in malattia localmente delimitata (limited disease) o in stadio avanzato (extended disease) [155] in base alla possibilità o meno di colpire in fase radioterapica la massa tumorale mediante un'unica irradiazione.[1] Le forme di tumore non a piccole cellule vengono classificate in base all'estensione del tumore (parametro T), alla localizzazione di linfonodi coinvolti (N) e alla presenza di metastasi (M). Con tali reperti è possibile procedere alla classificazione mediante la seguente tabella:[127]
|
Come è possibile notare, la presenza di metastasi a distanza, qualunque sia l'estensione e la presenza di metastasi linfonodali, promuove il tumore in categoria IV, caratterizzata da inoperabilità e sopravvivenza bassissima a un anno.[1] Un'ulteriore particolarità è rappresentata dal fatto che carcinomi privi di metastasi caratterizzati da parametri T4 o N3 sono sempre assegnati al grado IIIb. Sono considerati operabili gli stadi Ia, Ib, IIa, IIb e alcuni IIIa (pazienti in buone condizioni di salute e senza esteso coinvolgimento linfonodale).[154] Gli stadi IIIb e IV sono da considerare sempre inoperabili; il trattamento di elezione è rappresentato dalla chemioterapia e dalla radioterapia.[74]
Estensione e localizzazione del tumore - T |
Il grado T può essere indagato mediante metodiche tomografiche, di risonanza magnetica (poco utilizzata nel polmone) e di videotoracoscopia; quest'ultima trova particolare impiego nell'analisi del coinvolgimento mediastinico e delle strutture vascolari.[154]
Tx: con Tx si vuole indicare la presenza di tumore certo ma non ancora rilevabile mediante metodiche radiografiche e videoscopiche. La certezza di tumore è indicata dalla presenza di cellule maligne nell'escreato o nel liquido di lavaggio brochiolo-alveolare (BAL).[1]
T0: assenza di tumore.
T1: tumore confinato all'interno del polmone e con un diametro inferiore a 3 cm. Non coinvolge i bronchi principali.
T2: tumore con almeno una delle seguenti caratteristiche (diviso poi nei sottostadi a e b come descritto sotto):
- coinvolgimento del bronco principale ma distante più di 2 cm dalla biforcazione della trachea
- invasione della pleura viscerale
- presenza di atelectasia o di polmonite ostruttiva che non coinvolge l'intero polmone[74]
- a: tra 3 e 5 cm di diametro
- b: tra 5 e 7 cm
- coinvolgimento del bronco principale ma distante più di 2 cm dalla biforcazione della trachea
T3: tumore con almeno una delle seguenti caratteristiche:
- diametro > 7cm
- invasione della parete toracica, diaframma, pericardio parietale
- coinvolgimento del bronco principale a meno di 2 cm dalla trachea ma senza coinvolgere la biforcazione bronchiale
atelectasia o polmonite dell'intero polmone[74]
- presenza di noduli satelliti nello stesso lobo
T4: tumore con almeno una delle seguenti caratteristiche:
- tumore di qualsiasi dimensione ma che invade il mediastino, il cuore, i grandi vasi mediastinici, la trachea, l'esofago o le vertebre
- noduli tumorali satelliti in uno dei lobi omolaterali[1]
- tumore di qualsiasi dimensione ma che invade il mediastino, il cuore, i grandi vasi mediastinici, la trachea, l'esofago o le vertebre
Coinvolgimento linfonodale - N |
Con N si fa riferimento ai linfonodi coinvolti dal processo tumorale. Tale indagine può essere svolta mediante tomografia computerizzata o a emissione di positroni. Il limite più spiccato di queste metodiche è l'incapacità di visualizzare coinvolgimenti senza tumefazione (nel caso della TC) e l'incapacità di dare informazioni su piccole formazioni (PET). Per questo, i linfonodi prelevati in corso di procedure di chirurgia toracica come la lobectomia o la pneumectomia, devono essere sempre analizzati in ambito anatomo-patologico per la ricerca di processi infiltrativi non espansivi e quindi non visualizzabili mediante procedure radiografiche.[154]
Nx: metastasi linfonodali non rilevabili
N0: assenza di linfonodi colpiti
N1: colpiti i linfonodi subsegmentali, segmentali, lobari, interlobari o ilari omolaterali
N2: colpiti i linfonodi mediastinici omolaterali
N3: colpiti i linfonodi controlaterali o i linfonodi cervicali omolaterali
Presenza di metastasi - M |
Il grado M può essere indagato con la tomografia computerizzata al torace e all'addome (surreni), la risonanza magnetica (soprattutto i distretti encefalici) e la scintigrafia ossea.[127]
Mx: metastasi a distanza non rilevabili
M0: assenza di metastasi
M1: presenza di metastasi a distanza (diviso in a e b secondo i criteri sotto):
- a: noduli separati nel polmone controlaterale, noduli pleurici o versamento pleurico o pericardico maligno
- b: metastasi a distanza
Terapia |
La terapia del carcinoma del polmone dipende dal tipo cellulare, dall'estensione della malattia e dalle condizioni di salute del paziente (valutabili con l'indice di Karnofsky). I trattamenti comuni includono chirurgia, chemioterapia e radioterapia.[156]
Chirurgia |

Immagine che illustra la via di accesso chirurgico per la rimozione di un carcinoma del polmone

Immagine che illustra la metodica della resezione atipica ("wedge resection"), con la quale viene asportata la neoplasia e piccola parte del parenchima polmonare circostante
Una volta confermata la presenza di neoplasia, la tomografia computerizzata e a emissione di positroni sono strumenti necessari per la valutazione di resecabilità del tumore (eliminazione della maggior quantità possibile di tumore), condizionata dall'estensione, dall'infiltrazione degli organi vicini e dalla presenza di metastasi.
Elementi che invece influenzano l'operabilità (sopravvivenza e qualità di vita del paziente in seguito all'operazione) possono essere gli esami del sangue e la spirometria: mentre i primi possono indicare la presenza di comorbidità come il diabete, l'insufficienza respiratoria o l'insufficienza renale, la spirometria è in grado di valutare in maniera semplice e rapida la presenza di gravi BPCO, condizione che rappresenta una notevole limitazione alla chirurgia. Analogamente, deve essere effettuato un profilo elettrocardiografico al fine di valutare la presenza di aritmie o altre patologie cardiache.
La chirurgia toracica (con accesso toracotomico, vedi immagine) per il carcinoma del polmone ha un tasso di mortalità totale del 4,4%, strettamente correlato alla funzione polmonare e alla presenza di altri fattori di rischio.[157] La chirurgia rappresenta il primo presidio terapeutico nei NSCLC confinati a un polmone e fino allo stadio IIIa[158] (la stadiazione si assegna pre-operatoriamente attraverso la tomografia computerizzata e a emissione di positroni). Inoltre, deve essere valutata la capacità respiratoria in modo da poter predire la funzionalità residua in seguito all'intervento chirurgico.
Le procedure chirurgiche comprendono la resezione atipica [159](wedge resection rimozione del tessuto neoplastico e di piccola parte del parenchima polmonare che lo circonda), la segmentectomia (rimozione di una sezione di parenchima ventilato da un bronco segmentale), la lobectomia (rimozione di un lobo intero), la bilobectomia (rimozione di due lobi) e la pneumonectomia (rimozione dell'intero polmone). Nei pazienti con riserva funzionale adeguata, la lobectomia costituisce l'opzione di scelta, in quanto minimizza la possibilità locale di recidiva. Nei pazienti che non hanno un'adeguata riserva funzionale, la wedge resection costituisce una valida alternativa.[160] La brachiterapia con frammenti di iodio applicata ai margini dell'escissione wedge può ridurre il tasso di recidiva con risultati comparabili alla lobectomia.[161]
La chirurgia toracica video assistita (VATS = Video-Assisted Thoracic Surgery) (approccio mini-invasivo) e le procedure di lobectomia condotte con questo metodo possono presentare vantaggi nel più rapido recupero post-operatorio, nella più breve degenza e nei diminuiti costi da parte dell'ospedale.[162]
La presenza di tumore polmonare confinato e associato a nodulo surrenale solitario metastatico può in alcuni casi essere trattato con associazione di interventi chirurgici finalizzati sia alla rimozione del tumore primitivo sia della metastasi, con buoni tassi di sopravvivenza.[163] È stato inoltre dimostrato[164] che nei soggetti con metastasi surrenali sincrone o metacrone, la surrenectomia costituisce un intervento che può aumentare la sopravvivenza a 5 anni nei soggetti con tumore polmonare avanzato.
Chemioterapia |
Struttura molecolare del cisplatino, farmaco chemioterapico di nuova generazione utilizzato per la terapia del carcinoma del polmone

Struttura molecolare del celecoxib, un FANS di nuova generazione che ha trovato impiego nei casi di malattia diffusa nel carcinoma polmonare a piccole cellule
Il carcinoma polmonare a piccole cellule viene trattato primariamente con la chemioterapia e la radioterapia, poiché la chirurgia non ha dimostrato influenzare la sopravvivenza, benché alcune ricerche abbiano dimostrato che pazienti con SCLC confinato e senza coinvolgimento linfonodale risultino trarre giovamento in termini di sopravvivenza con l'associazione di chirurgia e chemioterapia.[165][166][167]
La chemioterapia rappresenta anche il primario approccio terapeutico in caso di NSCLC metastatico.
La combinazione di regime dipende dal tipo di tumore. Spesso i carcinomi non a piccole cellule vengono trattati con cisplatino o carboplatino in combinazione con gemcitabina, paclitaxel, docetaxel, etoposide o vinorelbina.[168] Nel carcinoma a piccole cellule sono comunemente usati il cisplatino e l'etoposide.[169] Possono essere anche usate le combinazioni con carboplatino, gemcitabina, paclitaxel, vinorelbina, topotecano ed irinotecano.[170][171] In caso di malattia diffusa, il celecoxib può essere associato in maniera sicura con l'etoposide, migliorando i risultati in termini di sopravvivenza rispetto alle precedenti combinazioni.[172]
Chemioterapia adiuvante per NSCLC |
Questo termine indica l'uso di chemioterapia in associazione contemporanea con altre terapie, come la chirurgia e la radioterapia. Durante le procedure chirurgiche devono essere prelevati i linfonodi; se in seguito all'esame istologico risultassero positivi per presenza di cellule neoplastiche, il tumore viene classificato in stadio II o III (in base al gruppo colpito). In questa situazione, la chemioterapia adiuvante può incrementare il tasso di sopravvivenza del 15%,[173][174] soprattutto se vengono usati farmaci contenenti platino, come il cisplatino e il carboplatino.[175]
L'uso di questo schema chemioterapico nei pazienti in stadio Ib è invece controverso, poiché le prove cliniche non hanno ancora dimostrato un beneficio in termini di sopravvivenza.[176][177] I test di valutazione in termini di sopravvivenza per la chemioterapia pre-operatoria (chemioterapia neoadiuvante) nei tumori completamente resecabili non sono stati finora conclusivi.[178]
Radioterapia |
La radioterapia è spesso associata alla chemioterapia nei pazienti con carcinoma polmonare non a piccole cellule che non possono essere sottoposti all'intervento chirurgico. Questa forma di radioterapia è chiamata radioterapia radicale.[179] Un perfezionamento di questa tecnica è la radioterapia continua accelerata iperfrazionata (CHART), nella quale un'elevata dose è somministrata in un breve periodo di tempo.[17] Nei casi di carcinoma polmonare a piccole cellule potenzialmente curabili, l'irradiazione del torace è raccomandata in associazione alla chemioterapia.[180] L'uso della radioterapia adiuvante per i NSCLC è ancora controverso, benché diversi benefici siano stati documentati nei tumori con coinvolgimento dei linfonodi mediastinici.[181][182]
Sia per i NSCLC sia per i SCLC, i pazienti possono trarre giovamento per il controllo del dolore e dei sintomi attraverso piccole dosi di radioterapia (radioterapia palliativa).
La brachiterapia (radioterapia localizzata) può avere un effetto diretto nei tumori confinanti a una piccola sezione di bronco.[183] Può essere inoltre usata quando un tumore inoperabile causa l'ostruzione di una via aerea di grandi dimensioni.[184]
La somministrazione di terapia radiativa craniale profilattica (PCI) ai pazienti con SCLC in stadio limitato è spesso usata per ridurre il rischio di metastasi in tal sede.[185] Più recentemente, la PCI ha dimostrato analoghi benefici nei soggetti con malattia avanzata.[186] Nei pazienti di cui il cancro è migliorato dopo un ciclo di chemioterapia, la PCI è indicata per ridurre il rischio cumulativo di metastasi al cervello a un anno dal 40,4% al 14,6%.[187]
I recenti miglioramenti nell'ottimizzazione e nella formazione dell'immagine radiografica hanno condotto allo sviluppo di tecniche di radioterapia stereotassica per il trattamento di carcinoma del polmone in fase iniziale. Questa metodica viene primariamente utilizzata in quei soggetti che, presentando co-morbidità, non possono essere candidati all'exeresi chirurgica.[188]
Radiologia interventistica |
L'ablazione con radiofrequenza è una tecnica che rappresenta un'alternativa per il trattamento di neoplasie polmonari primitive e secondarie, nei pazienti che, per le scarse condizioni cliniche generali, non possono essere sottoposte a intervento chirurgico. La procedura consite nell'inserimento sotto guida TC o ecografica di un agoelettrodo all'interno della lesione. Questo agoelettrodo è costituito da uncini che si dispiegano così all'interno della lesione stessa determinando un'area di necrosi coagulativa.[189][190]
Terapia mirata |
Struttura molecolare del Gefitinib, un farmaco in grado di bloccare la fosforilazione dei domini tirosin chinasici nelle cellule di carcinoma del polmone
Sono stati sviluppati vari farmaci mirati (targeted therapy) per il trattamento del carcinoma del polmone. Il gefitinib ha come bersaglio i domini tirosin chinasici del recettore del fattore di crescita dell'epidermide (EGFR), iperespresso o mutato in modo da essere costitutivamente attivo nelle diverse forme di carcinoma polmonare non a piccole cellule. Benché diverse prove abbiano dimostrato che il farmaco non sia in grado di migliorare i profili di sopravvivenza a 5 anni, il gefitinib dimostra una buona efficacia nel trattamento del carcinoma bronchioloalveolare in donne non fumatrici di origine asiatica.[191][192]
Successivamente è stato scoperto che i principali fattori predittivi di risposta a questi inibitori sono gli stati mutazionali dei geni EGFR e Ras. Bisogna quindi verificare che il primo possegga mutazioni attivanti (in quanto il gene mutato si è visto essere più sensibile ai farmaci) e il secondo no (in quanto il segnale inibitorio verso il nucleo non verrebbe trasmesso)
L'erlotinib, un altro inibitore dei domini tirosin chinasici, si è dimostrato efficace in termine di aumento del tasso di sopravvivenza nei pazienti con NSCLC[193] ed è attualmente considerato dalla Food and Drug Administration come trattamento di seconda linea nelle neoplasie avanzate. Analogamente al gefitinib, ha dimostrato una maggiore efficacia nel trattamento del carcinoma bronchioloalveolare in donne non fumatrici di origine asiatica.[192]
L'associazione di paclitaxel e carboplatino con bevacizumab, un inibitore dell'angiogenesi, migliora il tasso di sopravvivenza nei pazienti con NSCLC in stadio avanzato,[194] benché il suo uso sia connesso a un aumento del rischio di sanguinamento polmonare soprattutto nei soggetti con carcinoma polmonare a cellule squamose.
Ricerche e studi in future terapie focalizzano l'attenzione su nuovi farmaci citotossici,[195] sulla farmacogenetica[196] e sulla ingegneria farmaceutica in grado di "disegnare" nuove molecole specifiche.[197] Alcune terapie mirate, come quelle a base di inibitori della COX-2,[198] di exisulind (uno stimolatore dell'apoptosi),[199] di inibitori della proteasi,[200] di bexarotene[201] e di alcuni vaccini,[202] sono ancora oggetto di studi preliminari. Le future aree di ricerca includono lo studio degli inibitori del protoncogene Ras, degli inibitori della PI3K, degli inibitori della deacetilasi degli istoni e dei farmaci in grado di sostituire gli oncosoppressori.[203]
Prognosi |

Sopravvivenza percentuale a 5 anni in base allo stadio tumorale.[204]
La prognosi viene basata sul tipo istologico e sulla stadio del tumore. Il carcinoma polmonare a piccole cellule ha una prognosi infausta, benché interventi di radioterapia e chemioterapia mirata nella forma localmente delimitata siano in grado di aumentare la sopravvivenza a 5 anni fino al 5%.[205] Nelle forme di carcinoma polmonare non a piccole cellule la sopravvivenza dipende soprattutto dalla classificazione, benché deve essere sempre considerata la presenza di patologie concomitanti e l'indice di Karnofsky calcolato per il paziente in osservazione. Nell'immagine a fianco sono messe a confronto le curve di sopravvivenza per la classificazione (o stadiazione) clinica (cTNM), ovvero basata sui reperti strumentali pre-operatori come la tomografia computerizzata, la tomografia ad emissione di positroni e la videotoracoscopia, e quella per la stadiazione patologica (pTNM), basata sull'analisi anatomo-patologica e microscopica delle stazioni linfonodali e dei frammenti prelevati in seguito all'intervento di chirurgia toracica. Come è possibile notare, è presente una notevole discrepanza tra i due metodi di classificazione: questo significa che la stadiazione operata su valutazione clinica (cTNM, pre-operatoria) sottovaluta la reale estensione della neoplasia[204], ad esempio un IIb clinico ha lo stesso indice di sopravvivenza di un IIIa anatomo-patologico. Ulteriori elementi prognosticamente sfavorevoli sono la presenza di sindromi paraneoplastiche come la sindrome di Cushing, la sindrome da inappropriata secrezione di ADH e l'ipercalcemia. Quest'ultima, unitamente alla presenza di iperkaliemia da lisi neoplastica e all'insufficienza renale, può aggravare il quadro patologico per lo sviluppo di gravi quadri aritmici.[132] La comparsa di sindromi mediastiniche come disfonia, disfagia, grave dispnea e sindrome della vena cava superiore testimoniano la presenza di una malattia estesa, con rapida evoluzione verso l'exitus.[206]
La presenza di polmonite da ostruzione, atelectasia e versamento pleurico sono condizioni che, oltre a condizionare la stadiazione e quindi la prognosi, rappresentano ulteriori condizioni di comorbidità che devono essere trattate con terapie specifiche e mirate.[154]
|
Prevenzione |
Per definizione, le misure preventive hanno come scopo l'eliminazione dei fattori eziologici e dei fattori di rischio. In questa ottica, la misura preventiva più efficace per ridurre l'incidenza di carcinoma del polmone è ridurre al minimo l'esposizione al fumo di sigaretta, sia esso attivo o passivo.[207] In seguito alle evidenze mostrate dagli studi citati in precedenza, risulta essere molto importante prevenire l'esposizione al fumo soprattutto nei soggetti giovani.[40] Negli Stati Uniti d'America, il Centers for Disease Control, un ente che si occupa del controllo e della prevenzione delle malattie, ha proposto diversi programmi di prevenzione.[208]
A partire dal 1998, negli stati occidentali degli USA come la California sono state prese numerose misure per diminuire l'esposizione al fumo passivo nei luoghi pubblici. In seguito, analoghe misure sono state prese in Europa, con l'Irlanda nel 2004, l'Italia e la Norvegia nel 2005, la Scozia nel 2006, l'Inghilterra nel 2007 e la Francia nel 2008. La Nuova Zelanda ha cominciato ad applicare misure contro il fumo nei luoghi pubblici nel 2004. Nello Stato del Bhutan, dal 2005, è in vigore una legge che impone il completo divieto di fumo.[209] In molti paesi, gruppi attivi nella lotta contro il fumo stanno facendo una campagna per simili divieti. Nel 2007, Chandigarh è diventato la prima città indiana a diventare "senza fumo". L'India ha introdotto un divieto totale di fumo ai luoghi pubblici il 2 ottobre 2008.
Tuttavia, una politica eccessivamente tesa al proibizionismo nei confronti del fumo di tabacco si è dimostrata essere positivamente correlata allo sviluppo di attività criminali di contrabbando, il che ha portato a porre un limite allo sviluppo di decreti legislativi troppo restrittivi.[210]
Nel 2008, uno studio condotto su oltre 77000 soggetti adulti ed anziani ha dimostrato che l'utilizzo protratto di integratori multivitaminici contenenti folati, vitamina C e vitamina E non è in grado di prevenire l'incidenza di carcinoma del polmone. Inoltre, è stato osservato che un uso intenso di vitamina E, soprattutto se condotto per lunghi periodi, è associato ad un aumento del rischio per lo sviluppo di carcinoma del polmone.[211]
L'Organizzazione mondiale della sanità ha richiesto ai governi di eliminare completamente la pubblicità riguardanti il tabacco per prevenire che i giovani inizino a fumare, sostenendo che, nei paesi in cui queste misure sono già state prese, il consumo di tabacco si è già ridotto del 16%.[212]
Per limitare l'esposizione al radon è possibile effettuare un controllo della quantità di questo gas nella propria abitazione tramite la sede ARPA più vicina.
Screening |
Lo scopo dello screening è quello di identificare le malattie presenti in una comunità in una fase precoce, permettendo così di giungere ad interventi terapeutici tempestivi ed alla gestione standardizzata della terapia al fine di ridurre in maniera significativa la mortalità. In questo senso, in Italia gli screening oncologici sono rivolti all'identificazione precoce del cancro della mammella, del cancro del colon-retto e del cancro della cervice uterina.[213] Per il carcinoma del polmone il discorso è invece più complesso: lo screening in soggetti a rischio asintomatici svolto mediante l'esame citologico dell'espettorato, la radiografia del torace e la tomografia computerizzata non è sufficiente a garantire una riduzione della mortalità per carcinoma del polmone.[214] Nel 2004, sulla base di queste evidenze la US Preventive Services Task Force ha affermato che i risultati a lungo termine dello screening sulla mortalità per carcinoma del polmone non sono sufficienti per istituire un programma nazionale basato sulle metodiche di indagine prese in considerazione.[215] Nel 2007 anche l'American College of Chest Physicians ha raccomandato di non eseguire esami di screening per il carcinoma del polmone a causa della mancanza di efficacia sulla riduzione del tasso di mortalità.[216]
Metodica TC spirale a basse dosi |
Nel 2006, la International Early Lung Cancer Action Project (I-ELCAP) ha pubblicato i risultati di uno screening fondato sulla metodica TC spirale a basse dosi applicato su 31.000 soggetti ad alto rischio.[217] Furono diagnosticate 484 neoplasie polmonari; tra queste, circa l'85% era in stadio I (neoplasie di piccolo diametro completamente resecabili con una sopravvivenza a 10 anni dell'88%). Sono state mosse diverse critiche allo studio I-ELCAP:
- Metodica: i risultati ottenuti non vennero confrontati con un gruppo di controllo composto da soggetti sottoposti allo screening con radiografia del torace.
- Risultati a lungo termine: i soggetti vennero seguiti per circa 40 mesi. Sono dunque assenti i risultati a 10 anni.
In Giappone, lo screening basato sulla metodica TC a basse dosi è stato comparato allo screening basato sulla radiografia del torace.[218][219][220] Da questi studi è risultato che:
- Rispetto alla radiografia, la TC spirale a basse dosi è in grado di rilevare un maggior numero di neoplasie polmonari ancora resecabili.
- In virtù della potenza risolutiva, la TC spirale è caratterizzata da un elevato numero di falsi positivi.
- Al fine di ridurre i falsi positivi è utile sottoporre i soggetti con immagini TC positive all'analisi citologica dell'espettorato e dei marcatori tumorali.
Uno studio di 5 anni pubblicato nel 2005 ha ulteriormente dimostrato la validità della TC spirale a basse dosi, pur evidenziando l'elevato numero di falsi positivi (96% per tutte le formazioni nodulari, 92% per i noduli superiori a 4 mm).[221]
In contrasto, nel marzo 2007, uno studio pubblicato nel Journal of the American Medical Association ha dimostrato l'assenza di benefici sulla mortalità dello screening basato sulla metodica TC a bassi dosi.[222][223]
Test del respiro |
Mediante un dispositivo simile a quello utilizzato nel breath test per la ricerca di Helicobacter pylori è possibile "intrappolare" ed analizzare le proteine emesse dal soggetto durante l'espirazione: successive analisi fondate sulle moderne tecniche di proteomica consentono di ricavare un profilo qualitativo e quantitativo di queste proteine. Questa metodica è volta a ricercare modificazioni nella tipologia o nella quantità di proteine che possano essere correlate con la presenza di alterazioni neoplastiche delle strutture polmonari, anche qualora siano ancora in uno stato iniziale. Benché siano necessarie altre prove di efficacia, alcuni studi hanno dimostrato come la metodica non-invasiva del test del respiro possa garantire un'elevata sensibilità con costi esigui e rapidità di indagine.[224]
Note |
^ abcdefghi Harrison
^ ab Incidence & Mortality, Lung cancer (PDF), Surveillance, Epidemiology and End Results, 2009. URL consultato il 1º luglio 2009.
^ abcdefghij Robbins e Cotran
^ (LA) Giovanni Battista Morgagni, De sedibus et causis morborum per anatomen indagatis, 1761.
^ (FR) Gaspard-Laurent Bayle, Recherches sur la phtisie pulmonaire, Paris, 1810.
^ ab H Witschi, A short history of lung cancer, in Toxicological Sciences, vol. 64, nº 1, novembre 2001, pp. 4–6, DOI:10.1093/toxsci/64.1.4, PMID 11606795.
^ Isaac Adler, Primary Malignant Growths of the Lungs and Bronchi: A pathological and clinical study, New York, Longmans, Green, and Company, 1912., citato in Spiro SG, Silvestri GA, One hundred years of lung cancer, in American Journal of Respiratory and Critical Care Medicine, vol. 172, nº 5, 2005, pp. 523–529, DOI:10.1164/rccm.200504-531OE, PMID 15961694.
^ FW Grannis, History of cigarette smoking and lung cancer, smokinglungs.com. URL consultato il 30 giugno 2009.
^ R Proctor, The Nazi War on Cancer, Princeton University Press, 2000, pp. 173–246, ISBN 978-0-691-07051-3.
^ R. Doll, Hill A.B., Lung cancer and other causes of death in relation to smoking; a second report on the mortality of British doctors, in British Medical Journal, vol. 2, nº 5001, novembre 1956, pp. 1071–1081, DOI:10.1136/bmj.2.5001.1071, PMID 13364389.
^ US Department of Health Education and Welfare, Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service (PDF), Washington, DC, US Government Printing Office, 1964.
^ M. Pirozynski, 100 years of Lung Cancer, in Respiratory Medicine, vol. 100, nº 12, dicembre 2006, pp. 2073–2084, DOI:10.1016/j.rmed.2006.09.002, PMID 17056245.
^ M. Greaves, Cancer: the Evolutionary Legacy, Oxford University Press, 2000, pp. 196–197, ISBN 978-0-19-262835-0.
^ L. Horn, Johnson D.H., Evarts A. Graham and the first pneumonectomy for lung cancer (PDF), in Journal of Clinical Oncology, vol. 26, nº 19, luglio 2008, pp. 3268–3275, DOI:10.1200/JCO.2008.16.8260, PMID 18591561.
^ A.T. Edwards, Carcinoma of the bronchus, in Thorax, vol. 1, nº 1, 1946, pp. 1–25, DOI:10.1136/thx.1.1.1, PMID 1018207.
^ (DE) M Kabela, Experience with radical irradiation of bronchial cancer, in Ceskoslovenská Onkológia, vol. 3, nº 2, 1956, pp. 109–115, PMID 13383622.
^ ab M Saunders, Dische S, Barrett A et al., Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial, in The Lancet, vol. 350, nº 9072, luglio 1997, pp. 161–165, DOI:10.1016/S0140-6736(97)06305-8, PMID 9250182.
^ S.C. Lennox, Flavell G., Pollock D.J. et al., Results of resection for oat-cell carcinoma of the lung, in The Lancet, vol. 2, nº 7575, novembre 1968, pp. 925–927, DOI:10.1016/S0140-6736(68)91163-X, PMID 4176258.
^ A.B. Miller, Fox W., Tall R., Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus, in The Lancet, vol. 2, nº 7619, settembre 1969, pp. 501–505, DOI:10.1016/S0140-6736(69)90212-8, PMID 4184834.
^ M Cohen, Creaven PJ, Fossieck BE Jr et al., Intensive chemotherapy of small cell bronchogenic carcinoma, in Cancer Treatment Reports, vol. 61, nº 3, 1977, pp. 349–354, PMID 194691.
^ Commonly diagnosed cancers worldwide, Cancer Research UK, aprile 2005. URL consultato il 2 luglio 2009 (archiviato dall'url originale il 10 gennaio 2008).
^ ab Alberg AJ, Ford JG, Samet JM, Epidemiology of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition) .mw-parser-output .chiarimento{background:#ffeaea;color:#444444}.mw-parser-output .chiarimento-apice{color:red}
[collegamento interrotto], in Chest, vol. 132, nº 3, settembre 2007, pp. 29S-55S, DOI:10.1378/chest.07-1347, PMID 17873159.
^ Gender in lung cancer and smoking research (PDF), Organizzazione mondiale della sanità (WHO), 2004. URL consultato il 2 luglio 2009.
^ YM Coyle, Minahjuddin AT, Hynan LS, Minna JD, An ecological study of the association of metal air pollutants with lung cancer incidence in Texas, in Journal of Thoracic Oncology, vol. 1, nº 7, settembre 2006, pp. 654–661, PMID 17409932.
^ HF Chiu, Cheng MH, Tsai SS et al., Outdoor air pollution and female lung cancer in Taiwan, in Inhalation Toxicology, vol. 18, nº 13, dicembre 2006, pp. 1025–1031, DOI:10.1080/08958370600904561, PMID 16966302.
^ Z Kabir, Bennett K, Clancy L, Lung cancer and urban air-pollution in Dublin: a temporal association?, in Irish Medical Journal, vol. 100, nº 2, febbraio 2007, pp. 367–369, PMID 17432813.
^ ME Parent, Rousseau MC, Boffetta P et al., Exposure to diesel and gasoline engine emissions and the risk of lung cancer (PDF), in American Journal of Epidemiology, vol. 165, nº 1, gennaio 2007, pp. 53–62, DOI:10.1093/aje/kwj343, PMID 17062632.
^ BQ Liu, Peto R, Chen ZM et al., Emerging tobacco hazards in China: 1. Retrospective proportional mortality study of one million deaths, in British Medical Journal, vol. 317, nº 7170, 21 novembre 1998, pp. 1411–1422, PMID 9822393.
^ D Behera, Balamugesh T, Lung cancer in India (PDF), in Indian Journal of Chest Diseases and Allied Sciences, vol. 46, nº 4, 2004, pp. 269–281, PMID 15515828.
^ SB Mohr, Garland CF, Gorham ED et al., Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?, in Journal of Epidemiology and Community Health, vol. 62, nº 1, 2008, pp. 69–74, DOI:10.1136/jech.2006.052571, PMID 18079336.
^ ab F Chen, Bina WF, Cole P, Declining incidence rate of lung adenocarcinoma in the United States
[collegamento interrotto], in Chest, vol. 131, nº 4, aprile 2007, pp. 1000–1005, DOI:10.1378/chest.06-1695, PMID 17426202.
^ A Charloux, Quoix E, Wolkove N et al., The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma (PDF), in International Journal of Epidemiology, vol. 26, nº 1, febbraio 1997, pp. 14–23, DOI:10.1093/ije/26.1.14, PMID 9126499.
^ ab Ferlay J, Autier P, Boniol M, et al., Estimates of the cancer incidence and mortality in Europe in 2006 (PDF), in Annals of oncology, vol. 18, nº 3, febbraio 2007, pp. 581-592, DOI:10.1093/annonc/mdl1498, PMID 17287242.
^ Stime preliminari della mortalità per causa nelle regioni italiane - Anno 2004 (PDF), Istat - Istituto nazionale di statistica, gennaio 2007. URL consultato il 21 giugno 2009.
^ ab I tumori in Italia, rapporto 2006 (PDF), Associazione italiana dei registri tumori (AIRTUM), febbraio 2006. URL consultato il 29 giugno 2009.
^ Tumore del polmone: annullate le differenze fra giovani uomini e donne, rapporto 2006 (PDF), Associazione italiana dei registri tumori (AIRTUM), febbraio 2006. URL consultato il 29 giugno 2009.
^ ab HK Biesalski, Bueno de Mesquita B, Chesson A et al., European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel (PDF), in CA Cancer J Clin, vol. 48, nº 3, 1998, pp. 167–176; discussion 164–166, DOI:10.3322/canjclin.48.3.167, PMID 9594919 (archiviato dall'url originale il 27 giugno 2011).
.mw-parser-output .citazione-table{margin-bottom:.5em;font-size:95%}.mw-parser-output .citazione-table td{padding:0 1.2em 0 2.4em}.mw-parser-output .citazione-lang{vertical-align:top}.mw-parser-output .citazione-lang td{width:50%}.mw-parser-output .citazione-lang td:first-child{padding:0 0 0 2.4em}.mw-parser-output .citazione-lang td:nth-child(2){padding:0 1.2em}
«Smoking is the major risk factor, accounting for about 90% of lung cancer incidence.»
^ R Peto, Lopez AD, Boreham J et al., Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics, Oxford University Press, 2006, ISBN 0-19-262535-7.
^ JM Samet, Wiggins CL, Humble CG, Pathak DR, Cigarette smoking and lung cancer in New Mexico, in American Review of Respiratory Disease, vol. 137, nº 5, maggio 1988, pp. 1110–1113, PMID 3264122.
^ ab K Asomaning, Second hand smoke, age of exposure and lung cancer risk, in Lung cancer, vol. 61, nº 1, luglio 2008, pp. 13-20, DOI:10.1016/j.lungcan.2007.11.013, PMID 18191495.
^ S Hecht, Tobacco carcinogens, their biomarkers and tobacco-induced cancer, in Nature Reviews. Cancer, vol. 3, nº 10, ottobre 2003, pp. 733–744, DOI:10.1038/nrc1190, PMID 14570033.
^ M Sopori, Effects of cigarette smoke on the immune system, in Nature Reviews. Immunology, vol. 2, nº 5, maggio 2002, pp. 372–7, DOI:10.1038/nri803, PMID 12033743.
^ US Department of Health and Human Services, The Health Benefits of Smoking Cessation: a Report of the Surgeon General, Centers for Disease Control (CDC), Office on Smoking and Health, 30 settembre 1990, vi, 130, 148, 152, 155, 164, 166. URL consultato il 3 luglio 2009.
^ LT Nordquist, Simon GR, Cantor A et al., Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung
[collegamento interrotto], in Chest, vol. 126, nº 2, agosto 2004, pp. 347–351, DOI:10.1378/chest.126.2.347, PMID 15302716.
^ CM Tammemagi, Neslund-Dudas C, Simoff M, Kvale P, Smoking and lung cancer survival: the role of comorbidity and treatment
[collegamento interrotto], in Chest, vol. 125, nº 1, American College of Chest Physicians, gennaio 2004, pp. 27–37, DOI:10.1378/chest.125.1.27, PMID 14718417.
^ S Schick, Glantz S, Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke, in Tobacco Control, vol. 14, nº 6, dicembre 2005, pp. 396–404, DOI:10.1136/tc.2005.011288, PMID 16319363.
^ Centers for Disease Control and Prevention, State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000, in Morbidity and Mortality Weekly Report, vol. 50, nº 49, dicembre 2001, pp. 1101–1106, PMID 11794619.
^ P Boffetta, Agudo A, Ahrens W et al., Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe (PDF), in Journal of the National Cancer Institute, vol. 90, nº 19, ottobre 1998, pp. 1440–1450, DOI:10.1093/jnci/90.19.1440, PMID 9776409.
^ Report of the Scientific Committee on Tobacco and Health, Department of Health, marzo 1998. URL consultato il 3 luglio 2009.
- AK Hackshaw, Lung cancer and passive smoking, in Statistical Methods in Medical Research, vol. 7, nº 2, giugno 1998, pp. 119–136, DOI:10.1191/096228098675091404, PMID 9654638.
^ National Health and Medical Research Council, The health effects and regulation of passive smoking, Australian Government Publishing Service, aprile 1994 (archiviato dall'url originale il 19 aprile 2015).
^ Catelinois O, Rogel A, Laurier D, et al., Lung cancer attributable to indoor radon exposure in France: impact of the risk models and uncertainty analysis, in Environ. Health Perspect., vol. 114, nº 9, settembre 2006, pp. 1361–6, DOI:10.1289/ehp.9070, PMID 16966089.
^ BBC news, Radon gas warning campaign: People living in Cornwall are being encouraged to have their homes tested for radon, su news.bbc.co.uk, 23 novembre 2003. URL consultato il 7 luglio 2009.
^ United States Environmental Protection Agency, Radiation information: radon, su epa.gov, ottobre 2006. URL consultato il 7 luglio 2009.
^ RW Field, Steck DJ, Smith BJ et al., Residential radon gas exposure and lung cancer: the Iowa Radon Lung Cancer Study (PDF), in American Journal of Epidemiology, vol. 151, nº 11, 1º giugno 2000, pp. 1091–1102, PMID 10873134.
^ Elisabetta Albini, Il radon negli edifici e nell'ambiente e luogo di lavoro, misurediradon.it. URL consultato il 7 luglio 2009.
^ Elisabetta Albini, Azioni di rimedio al gas radon, misurediradon.it. URL consultato il 7 luglio 2009.
^ Elisabetta Albini, La normativa radon in Italia, misurediradon.it. URL consultato il 7 luglio 2009.
^ KM O'Reilly, Mclaughlin AM, Beckett WS, Sime PJ, Asbestos-related lung disease, in American Family Physician, vol. 75, nº 5, marzo 2007, pp. 683–688, PMID 17375514.
^ AJ Darnton, McElvenny DM, Hodgson JT, Estimating the number of asbestos-related lung cancer deaths in Great Britain from 1980 to 2000, in Annals of Occupational Hygiene, vol. 50, nº 1, gennaio 2006, pp. 29–38, DOI:10.1093/annhyg/mei038, PMID 16126764.
^ www.unipg.it (PDF), su unipg.it. URL consultato il 10 gennaio 2012 (archiviato dall'url originale l'8 luglio 2011).
^ Beeson WL, Abbey DE, Knutsen SF, Long-term concentrations of ambient air pollutants and incident lung cancer in California adults: results from the AHSMOG study.Adventist Health Study on Smog, in Environ Health Perspect, 1998, PMID 9831542.
^ Kleinjans JC, van Maanen JM, van Schooten FJ., Human respiratory disease: environmental carcinogens and lung cancer risk, 1993, PMID 8222989.
^ C Leroux, Girard N, Cottin V et al., Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep, in Veterinary Research, vol. 38, nº 2, marzo-aprile 2007, pp. 211–228, DOI:10.1051/vetres:2006060, PMID 17257570.
^ M Palmarini, Fan H, Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer, in Journal of the National Cancer Institute, vol. 93, nº 21, novembre 2001, pp. 1603–1614, DOI:10.1093/jnci/93.21.1603, PMID 11698564.
^ YW Cheng, Chiou HL, Sheu GT et al., The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women, in Cancer Research, vol. 61, nº 7, 1º aprile 2001, pp. 2799–2803, PMID 11306446.
^ H Zheng, Aziz HA, Nakanishi Y et al., Oncogenic role of JC virus in lung cancer, in Journal of Pathology, vol. 212, nº 3, maggio 2007, pp. 306–315, DOI:10.1002/path.2188, PMID 17534844.
^ L Giuliani, Jaxmar T, Casadio C et al., Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma, in Lung Cancer, vol. 57, nº 3, settembre 2007, pp. 273–281, DOI:10.1016/j.lungcan.2007.02.019, PMID 17400331.
^ ab Neri
^ Smith G, Stubbins MJ, Harries LW, Wolf CR, Molecular genetics of the human cytochrome P450 monooxygenase superfamily, in Xenobiotica; the fate of foreign compounds in biological systems, vol. 28, nº 12, dicembre 1998, pp. 1129–65, DOI:10.1080/004982598238868, PMID 9890157.
^ Beresford AP, CYP1A1: friend or foe?, in Drug metabolism reviews, vol. 25, nº 4, 1993, pp. 503–17, DOI:10.3109/03602539308993984, PMID 8313840.
^ Burrows B et al., Quantitative Relationships Between Cigarette Smoking and Chronic Productive Cough, in International Journal of Epidemiology, vol. 6, nº 2, 1977, ISSN 1464-3685.
^ Catherine Limas, Hugo Japaze e Rafael Garcia-Bunuel, "Scar" Carcinoma of The Lung (PDF)
[collegamento interrotto], in Chest, vol. 59, nº 2, febbraio 1971, pp. 219-222, DOI:10.1378/chest.59.2.219.
^ Chapman, AD; Kerr, KM, The association between atypical adenomatous hyperplasia and primary lung cancer (PDF), in British Journal of Cancer, vol. 83, nº 8, agosto 2000, pp. 632-636, DOI:10.1054/bjoc.2000.1317, PMID 10944604.
^ abcde DeVita
^ ab Zhang H, Berezov A, Wang Q, Zhang G, Drebin J, Murali R, Greene MI, ErbB receptors: from oncogenes to targeted cancer therapies, in J. Clin. Invest., vol. 117, nº 8, agosto 2007, pp. 2051–8, DOI:10.1172/JCI32278, PMID 17671639.
^ abcdef Pontieri, Russo, Frati, Patologia generale, 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6.
^ Prudkin L, Wistuba II, Epidermal growth factor receptor abnormalities in lung cancer. Pathogenetic and clinical implications, in Annals of diagnostic pathology, vol. 10, nº 5, 2006, pp. 306–15, DOI:10.1016/j.anndiagpath.2006.06.011, PMID 16979526.
^ Ahmed SM, Salgia R, Epidermal growth factor receptor mutations and susceptibility to targeted therapy in lung cancer, in Respirology, vol. 11, nº 6, 2007, pp. 687–92, DOI:10.1111/j.1440-1843.2006.00887.x, PMID 17052295.
^ Goodsell DS, The molecular perspective: the ras oncogene, in Oncologist, vol. 4, nº 3, 1999, pp. 263–4, PMID 10394594.
^ Bos J, Ras oncogenes in human cancer: a review (PDF), in Cancer Res, vol. 49, nº 17, 1989, pp. 4682–9, PMID 2547513.
^ Downward J, Targeting RAS signalling pathways in cancer therapy, in Nat. Rev. Cancer, vol. 3, nº 1, gennaio 2003, pp. 11–22, DOI:10.1038/nrc969, PMID 12509763.
^ Rotblat B, Ehrlich M, Haklai R, Kloog Y, The Ras inhibitor farnesylthiosalicylic acid (Salirasib) disrupts the spatiotemporal localization of active Ras: a potential treatment for cancer, in Methods Enzymol, vol. 439, 2008, pp. 467–89, DOI:10.1016/S0076-6879(07)00432-6, PMID 18374183.
^ Lüscher B, Function and regulation of the transcription factors of the Myc/Max/Mad network, in Gene, vol. 277, 1-2, 2001, pp. 1–14, DOI:10.1016/S0378-1119(01)00697-7, PMID 11602341.
^ Nilsson JA, Cleveland JL, Myc pathways provoking cell suicide and cancer, in Oncogene, vol. 22, nº 56, 2004, pp. 9007–21, DOI:10.1038/sj.onc.1207261, PMID 14663479.
^ Dang CV, O'donnell KA, Juopperi T, The great MYC escape in tumorigenesis, in Cancer Cell, vol. 8, nº 3, 2005, pp. 177–8, DOI:10.1016/j.ccr.2005.08.005, PMID 16169462.
^ Charles A. Janeway, Immunobiologia, Padova, Piccin, 2007, ISBN 88-299-1814-8.
^ Matlashewski G, Lamb P, Pim D, Peacock J, Crawford L, Benchimol S, Isolation and characterization of a human p53 cDNA clone: expression of the human p53 gene, in Embo J., vol. 3, nº 13, dicembre 1984, pp. 3257–62, PMID 6396087.
^ Isobe M, Emanuel BS, Givol D, Oren M, Croce CM, Localization of gene for human p53 tumour antigen to band 17p13, in Nature, vol. 320, nº 6057, 1986, pp. 84–5, DOI:10.1038/320084a0, PMID 3456488.
^ Kern SE, Kinzler KW, Bruskin A, Jarosz D, Friedman P, Prives C, Vogelstein B, Identification of p53 as a sequence-specific DNA-binding protein, in Science, vol. 252, nº 5013, giugno 1991, pp. 1708–11, DOI:10.1126/science.2047879, PMID 2047879.
^ Han ES, Muller FL, Pérez VI, Qi W, Liang H, Xi L, Fu C, Doyle E, Hickey M, Cornell J, Epstein CJ, Roberts LJ, Van Remmen H, Richardson A, The in vivo gene expression signature of oxidative stress, in Physiol. Genomics, vol. 34, nº 1, giugno 2008, pp. 112–26, DOI:10.1152/physiolgenomics.00239.2007, PMID 18445702.
^ Rodriguez R, Meuth M, Chk1 and p21 cooperate to prevent apoptosis during DNA replication fork stress, in Mol. Biol. Cell, vol. 17, nº 1, gennaio 2006, pp. 402–12, DOI:10.1091/mbc.E05-07-0594, PMID 16280359.
^ Fornace, A.J.; Jackman, J.; Hollander, M.C.; Hoffman-Liebermann, B.; & Liebermann, D.A., Genotoxic-stress-response genes and growth-arrest genes: gadd, MyD, and other genes induced by treatments eliciting growth arrest, in Annals of the New York Academy of Sciences, vol. 663, 1992, pp. 139–153, DOI:10.1111/j.1749-6632.1992.tb38657.x, PMID 1482047.
^ Liebermann, D.A., Hoffman, B., Myeloid differentiation (MyD)/growth arrest DNA damage (GADD) genes in tumor suppression, immunity and inflammation (PDF), in Leukemia, vol. 16, nº 4, 2002, pp. 527–541, DOI:10.1038/sj.leu.2402477, PMID 11960329.
^ ZN Oltvai, Milliman, CL; Korsmeyer, SJ, Bcl-2 Heterodimerizes In Vivo with a Conserved Homolog, Bax, That Accelerates Programmed Cell Death, in Cell, vol. 74, agosto 1993, pp. 609–619, DOI:10.1016/0092-8674(93)90509-O.
^ Read, A. P.; Strachan, T., Chapter 18: Cancer Genetics, in Human molecular genetics 2, New York, Wiley, 1999, ISBN 0-471-33061-2 (archiviato dall'url originale il 24 agosto 2007).
^ Tsung-Ming Yang, Dario Barbone, Dean A. Fennell e V. Courtney Broaddus, Bcl-2 Family Proteins Contribute to Apoptotic Resistance in Lung Cancer Multicellular Spheroids, in American Journal of Respiratory Cell and Molecular Biology, vol. 41, dicembre 2008, pp. 14-23, DOI:10.1165/rcmb.2008-0320OC, PMID 19097992.
^ Heidi Chial, Tumor Suppressor (TS) Genes and the Two-Hit Hypothesis, Genes and disease - Nature education, 2008. URL consultato il 9 luglio 2009.
^ Murphree AL, Benedict WF, Retinoblastoma: clues to human oncogenesis, in Science, vol. 223, nº 4640, marzo 1984, pp. 1028–33, DOI:10.1126/science.6320372, PMID 6320372.
^ Definizione di LOH sul sito dell'Università Vita-Salute San Raffaele
^ S. Petersen, M. Aninat-Meyer, K. Schlüns, K. Gellert, M. Dietel, I. Petersen, Chromosomal alterations in the clonal evolution to the metastatic stage of squamous cell carcinomas of the lung (PDF), in British Journal of Cancer, vol. 82, dicembre 1999, pp. 65-73, DOI:10.1054/bjoc.1999.0878, PMID 10638968.
^ Malcolm Brock, Craig M. Hooker, Emi Ota-Machida, et al., DNA Methylation Markers and Early Recurrence in Stage I Lung Cancer (PDF), in The New England journal of medicine, vol. 358, marzo 2008, pp. 1118-1128, DOI:10.1054/bjoc.1999.0878, PMID 18337602.
^ ab Alberts, Johnson, Lewis, Raff, Roberts, Walter, Biologia molecolare della cellula, 4ª ed., Bologna, Zanichelli, 2004, ISBN 88-08-07891-4.
^ Scott B. Cohen, Mark E. Graham, George O. Lovrecz, et al., Protein composition of catalytically active human telomerase from immortal cells, in Science, vol. 315, 30 marzo 2007, pp. 1850-3, DOI:10.1126/science.1138596, PMID 17395830.
^ Thomas J. Lynch, Telomerase, Pancoast Tumors, and Lung Cancer in the Elderly, medscape.com, maggio 2000. URL consultato il 9 luglio 2009.
^ Yahata N, Ohyashiki K, Ohyashiki JH, et al., Telomerase activity in lung cancer cells obtained from bronchial washings (PDF), in Journal of national cancer institute, vol. 90, nº 9, maggio 1998, pp. 684-90, PMID 9586665.
^ Kakihana M, Yahata N, Hirano T, et al., Telomerase activity during carcinogenesis in the bronchus, in Oncology reports, vol. 9, nº 1, gen-feb 2002, pp. 43-9, PMID 11748453.
^ Erkan Dikmena, Murat Karaa, Günnur Dikmenb, et al., Detection of telomerase activity in bronchial lavage as an adjunct to cytological diagnosis in lung cancer, in European journal of cardio-thoracic surgery, vol. 23, novembre 2002, pp. 194-199, DOI:10.1016/S1010-7940(02)00741-8, PMID 12559342.
^ VEGF and angiogenesis in lung cancer, researchvegf.com. URL consultato il 9 luglio 2009.
^ D. Brattströma, M. Bergqvista, P. Hesseliusa, et al., Serum VEGF and bFGF adds prognostic information in patients with normal platelet counts when sampled before, during and after treatment for locally advanced non-small cell lung cancer, in Lung cancer, vol. 43, nº 1, gennaio 2004, pp. 55-62, DOI:10.1016/j.lungcan.2003.07.007, PMID 14698537.
^ Adi F. Gazdar e John D. Minna, Angiogenesis and the Multistage Development of Lung Cancers, in Clinical cancer research, vol. 6, maggio 2000, pp. 1611-1612, PMID 10815876.
^ John D. Minna, Nicotine exposure and bronchial epithelial cell nicotinic acetylcholine receptor expression in the pathogenesis of lung cancer, in Journal of clinical investigation, vol. 111, nº 1, gennaio 2003, pp. 31-33, DOI:10.1172/JCI17492, PMID 12511585.
^ Entrez Gene: CRMP1 collapsin response mediator protein 1, su ncbi.nlm.nih.gov. URL consultato il 9 luglio 2009.
^ Shih JY, Lee YC, Yang SC, et al., Collapsin response mediator protein-1: a novel invasion-suppressor gene, in Clin. Exp. Metastasis, vol. 20, nº 1, 2003, pp. 69–76, DOI:10.1023/A:1022598604565, PMID 12650609.
^ Brigstock DR, Regulation of angiogenesis and endothelial cell function by connective tissue growth factor (CTGF) and cysteine-rich 61 (CYR61), in Angiogenesis, vol. 5, nº 3, settembre 2002, pp. 153-165, DOI:10.1023/A:1023823803510, PMID 12831056.
^ Chang CC, Shih JY, Jeng YM, et al., Connective tissue growth factor and its role in lung adenocarcinoma invasion and metastasis, in J. Natl. Cancer Inst., vol. 96, nº 5, 2004, pp. 364–75, DOI:10.1093/jnci/djh059, PMID 14996858.
^ Shih JY, Yang SC, Hong TM, et al., Collapsin response mediator protein-1 and the invasion and metastasis of cancer cells, in Journal of the national cancer institute, vol. 93, nº 18, settembre 2000, pp. 1392–1400, DOI:10.1093/jnci793.18.1392, PMID 11562390.
^ M. A. Haralson e John R. Hassell, Extracellular matrix: a practical approach, Ithaca, N.Y, IRL Press, 1995, ISBN 0-19-963220-0.
^ Colognato H, Yurchenco P, Form and function: the laminin family of heterotrimers, in Dev. Dyn., vol. 218, nº 2, 2000, pp. 213–34, DOI:10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R, PMID 10842354.
^ Charles Pyke, Sirpa Salo, Elisabeth Ralfkiær, et al., Laminin-5 Is a Marker of Invading Cancer Cells in Some Human Carcinomas and Is Coexpressed with the Receptor for Urokinase Plasminogen Activator in Budding Cancer Cells in Colon Adenocarcinomas1 (PDF), in American association for cancer research, vol. 55, settembre 1995, pp. 4132-4139, PMID 7664291.
^ Moriya Y, Niki T, Yamada T, et al., Increased expression of laminin-5 and its prognostic significance in lung adenocarcinomas of small size. An immunohistochemical analysis of 102 cases, in Cancer, vol. 91, nº 6, marzo 2001, pp. 1129-41, DOI:10.1002/1097-0142(20010315)91:6<1129::AID-CNCR1109>3.0.CO;2-C, PMID 11267958.
^ Humphries M.J., Integrin structure, in Biochem. Soc. Trans., vol. 28, nº 4, 2000, pp. 311–339, DOI:10.1042/0300-5127:0280311, PMID 10961914.
^ CG Bredin, KG Sundqvist, D Hauzenberger, and J Klominek, Integrin dependent migration of lung cancer cells to extracellular matrix components (PDF), in European respiratory journal, vol. 11, febbraio 1998, pp. 400-407, PMID 9551745.
^ Sethi T, Rintoul RC, Moore SM, et al., Extracellular matrix proteins protect small cell lung cancer cells against apoptosis: A mechanism for small cell lung cancer growth and drug resistance in vivo, in Nature medicine, vol. 5, 1999, pp. 662-668, DOI:10.1038/9511, PMID 10371505.
^ Fong YC, Hsu SF, Wu CL, et al., Transforming growth factor-β1 increases cell migration and beta1 integrin up-regulation in human lung cancer cells, in Lung cancer, vol. 64, nº 1, aprile 2009, pp. 13-21, DOI:10.1016/j.lungcan.2008.07.010, PMID 18771813.
^ Shibue T, Weinberg RA., Integrin beta 1-focal adhesion kinase signaling directs the proliferation of metastatic cancer cells disseminated in the lungs, in The Proceedings of the National Academy of Sciences (US), giugno 2009, DOI:10.1073/pnas.0904227106, PMID 19502425.
^ V. Colby, Tumors of the lower respiratory tract, 3ª ed., Washington DC, American Registry of Pathology, 1995, ISBN 1-881041-17-4.
^ abcdef Bonadonna
^ WD Travis, Travis LB, Devesa SS, Lung cancer, in Cancer, vol. 75, Suppl. 1, gennaio 1995, pp. 191–202, DOI:10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y, PMID 8000996.
^ U Morandi, Casali C, Rossi G, Bronchial typical carcinoid tumors, in Seminars in Thoracic and Cardiovascular Surgery, vol. 18, nº 3, 2006, pp. 191–8, DOI:10.1053/j.semtcvs.2006.08.005, PMID 17185178.
^ B Etienne-Mastroianni, Falchero L, Chalabreysse L, et al., Primary sarcomas of the lung: a clinicopathologic study of 12 cases, in Lung Cancer, vol. 38, nº 3, dicembre 2002, pp. 283–289, DOI:10.1016/S0169-5002(02)00303-3, PMID 12445750.
^ A Bryant, Cerfolio RJ, Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer, in Chest, vol. 132, nº 1, luglio 2007, pp. 185–92, DOI:10.1378/chest.07-0442, PMID 17573517.
^ ab Rugarli
^ abc Cittadini
^ Giuseppe C. Balboni et al., Anatomia Umana, Vol. 1-2., Ristampa 2000, Milano, Edi. Ermes s.r.l., 1976, ISBN 88-7051-078-6.
^ abcdef Mariuzzi
^ abc James O'D. McGee, Peter G. Isaacson, Nicholas A. Wright, et al., Oxford Textbook of Pathology, New York, Oxford University Press, USA, 2007, ISBN 978-0-19-261972-3.
^ Angelelli, AA.VV., Diagnostica per immagini per studenti e medici di medicina generale, Napoli, Idelson-Gnocchi, 2008, ISBN 978-88-7947-489-4.
^ Alberto Oliaro, Manuale di malattie dell'apparato respiratorio. Chirurgia toracica, pneumologia, Minerva medica, 2007, ISBN 978-88-7711-547-8.
^ Dioguardi, Sanna, Moderni aspetti di semeiotica medica, 5ª ed., Roma, Società editrice universo, 2006, ISBN 978-88-89548-62-2.
^ abcd Fraser
^ Lee KS, Kim Y, Han J, et al., Bronchioloalveolar carcinoma: clinical, histopathologic, and radiologic findings (PDF), in Radiographics, vol. 17, nº 6, 1º novembre 1997, pp. 1345–57, PMID 9397450.
^ DR Jones, Detterbeck FC, Pancoast tumors of the lung, in Current Opinion in Pulmonary Medicine, vol. 4, nº 4, luglio 1998, pp. 191–7, DOI:10.1097/00063198-199807000-00001, PMID 10813231.
^ Adams, Raymond Delacy; Victor, Maurice; Ropper, Allan H., Adam and Victor's principles of neurology, New York, McGraw-Hill, 2001, ISBN 0-07-067497-3.
^ ab Lövgren M, Tishelman C, Sprangers M, et al., Symptoms and problems with functioning among women and men with inoperable lung cancer--a longitudinal study, in Lung Cancer, vol. 60, nº 1, aprile 2008, pp. 113-124, DOI:10.1016/j.lungcan.2007.09.015, PMID 17976859.
^ Superior Vena Cava Syndrome, eMedicine, dicembre 2008. URL consultato il 13 luglio 2009.
^ Greene, Frederick L., AJCC cancer staging manual, Berlin, Springer-Verlag, 2002, ISBN 0-387-95271-3.
^ J Honnorat, Antoine JC, Paraneoplastic neurological syndromes, in Orphanet Journal of Rare Diseases, vol. 2, maggio 2007, p. 22, DOI:10.1186/1750-1172-2-22, PMID 17480225.
^ Newsom-Davis J, Lambert-Eaton myasthenic syndrome, in Rev. Neurol. (Paris), vol. 160, nº 2, febbraio 2004, pp. 177–80, DOI:10.RN-02-2004-160-2-0035-3787-101019-ART04Controllare il valore del parametrodoi(aiuto), PMID 15034474.
^ Broadus AE, Mangin M, Ikeda K, et al., Humoral hypercalcemia of cancer. Identification of a novel parathyroid hormone-like peptide, in The New England Journal of Medicine, vol. 319, nº 9, settembre 1988, pp. 556–63, PMID 3043221.
^ Bartter FC, Schwartz WB, The syndrome of inappropriate secretion of antidiuretic hormone, in Am. J. Med, vol. 42, nº 5, 1967, pp. 790–806, DOI:10.1016/0002-9343(67)90096-4, PMID 5337379.
^ ab AA Vaporciyan, Nesbitt JC, Lee JS et al., Cancer Medicine, B C Decker, 2000, pp. 1227–1292, ISBN 1-55009-113-1.
^ W Hamilton, Peters TJ, Round A, Sharp D, What are the clinical features of lung cancer before the diagnosis is made? A population based case-control study, in Thorax, vol. 60, nº 12, dicembre 2005, pp. 1059–1065, DOI:10.1136/thx.2005.045880, PMID 16227326.
^ Fan YG, Hu P, Jiang Y, et al., Association between sputum atypia and lung cancer risk in an occupational cohort in yunnan, china, in Chest, vol. 135, nº 3, marzo 2009, pp. 778–85, DOI:10.1378/chest.08-1469, PMID 19265088.
^ abcde Patterson
^
"Cancro del Polmone"[collegamento interrotto], Lega svizzera contro il cancro, pp. 13 e 17
^ Living with a Diagnosis of Lung Cancer, Associazione Italiana Ricerca Cancro. URL consultato il 10 gennaio 2012.
^ TE Strand, Rostad H, Damhuis RA, Norstein J, Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude, in Thorax, vol. 62, giugno 2007, p. 991, DOI:10.1136/thx.2007.079145, PMID 17573442.
^ Dionigi, Basi teoriche e Chirurgia generale - Chirurgia specialistica (4ª edizione), Padova, Elsevier Masson, 2006, ISBN 978-88-299-1654-2.
^ www.ricercatumorifegatopolmone.com Archiviato il 27 maggio 2013 in Internet Archive.
^ A El-Sherif, Gooding WE, Santos R et al., Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis, in Annals of Thoracic Surgery, vol. 82, nº 2, agosto 2006, pp. 408–415, DOI:10.1016/j.athoracsur.2006.02.029, PMID 16863738.
^ HC Fernando, Santos RS, Benfield JR et al., Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer, in Journal of Thoracic and Cardiovascular Surgery, vol. 129, nº 2, febbraio 2005, pp. 261–267, DOI:10.1016/j.jtcvs.2004.09.025, PMID 15678034.
^ Casali G, Walker WS, Video-assisted thoracic surgery lobectomy: can we afford it?, in Eur J Cardiothorac Surg, vol. 35, nº 3, marzo 2009, pp. 423–8, DOI:10.1016/j.ejcts.2008.11.008, PMID 19136272.
^ Ian Hunt, Sheila C. Rankin, Loic Lang-Lazdunski, Combined lung resection and transdiaphragmatic adrenalectomy in patients with non-small cell lung cancer and homolateral solitary adrenal metastasis (PDF), in European journal of cardio-thoracic surgery, vol. 30, marzo 2006, pp. 194-195, PMID 16725337.
^ Tawee Tanvetyanon, Lary A. Robinson, Michael J. Schell, Vivian E. Strong, Rachna Kapoor, Daniel G. Coit, Gerold Bepler, Outcomes of Adrenalectomy for Isolated Synchronous Versus Metachronous Adrenal Metastases in Non–Small-Cell Lung Cancer: A Systematic Review and Pooled Analysis, in Journal of Clinical Oncology, vol. 26, nº 7, marzo 2008, pp. 1142-1147, DOI:10.1200/JCO.2007.14.2091.
^ M Lucchi, A Mussi, A Chella, A Janni, A Ribechini, GF Menconi e CA Angeletti, Surgery in the management of small cell lung cancer, in European Journal of Cardio-Thoracic Surgery, vol. 12, 1997, pp. 689-693, DOI:10.1016/S1010-7940(97)00161-9, PMID 9458136.
^ Hans Rostada, Anne Naalsund, Randi Jacobsena, Trond Eirik Stranda, Helge Scottc, Erik Heyerdahl Strømc, Jarle Norsteina, Small cell lung cancer in Norway. Should more patients have been offered surgical therapy? (PDF), in Eur J Cardiothorac Surg, vol. 26, pp. 782-786, DOI:10.1016/j.ejcts.2004.06.011, PMID 15450573.
^ Malcolm V. Brock, Craig M. Hooker, James E. Syphard, et al., Surgical resection of limited disease small cell lung cancer in the new era of platinum chemotherapy: Its time has come (PDF)
[collegamento interrotto], in The American Association for Thoracic Surgery, vol. 129, 2005, pp. 64-72, DOI:10.1016/j.jtcvs.2004.08.022, PMID 15632826.
^ A Clegg, Scott DA, Hewitson P, et al., Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review (PDF), in Thorax, vol. 57, nº 1, gennaio 2002, pp. 20–28, DOI:10.1136/thorax.57.1.20, PMID 11809985.
^ N Murray, Turrisi AT, A review of nome-line treatment for small-cell lung cancer, in Journal of Thoracic Oncology, vol. 1, nº 3, marzo 2006, pp. 270–8, PMID 17409868.
^ HA Azim, Ganti AK, Treatment options for relapsed small-cell lung cancer, in Anticancer drugs, vol. 18, nº 3, marzo 2007, pp. 255–261, DOI:10.1097/CAD.0b013e328011a547, PMID 17264756.
^ C MacCallum, Gillenwater HH, Second-line treatment of small-cell lung cancer, in Current Oncology Reports, vol. 8, nº 4, luglio 2006, pp. 258–264, DOI:10.1007/s11912-006-0030-8, PMID 17254525.
^ Araujo AM, Mendez JC, Coelho AL, et al., Phase II Study of Celecoxib with Cisplatin Plus Etoposide in Extensive-Stage Small Cell Lung Cancer, in Cancer Invest., vol. 27, marzo 2009, p. 1, DOI:10.1080/07357900802232756, PMID 19266367.
^ T Winton, Livingston R, Johnson D, et al., Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer, in New England Journal of Medicine, vol. 352, nº 25, giugno 2005, pp. 2589–2597, DOI:10.1056/NEJMoa043623, PMID 15972865.
«Adjuvant vinorelbine plus cisplatin has an acceptable level of toxicity and prolongs disease-free and overall survival among patients with completely resected early-stage non-small-cell lung cancer.»
^ JY Douillard, Rosell R, De Lena M et al., Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial, in Lancet Oncology, vol. 7, nº 9, settembre 2006, pp. 719–727, DOI:10.1016/S1470-2045(06)70804-X, PMID 16945766.
^ M Tsuboi, Ohira T, Saji H et al., The present status of postoperative adjuvant chemotherapy for completely resected non-small cell lung cancer (PDF), in Annals of Thoracic and Cardiovascular Surgery, vol. 13, nº 2, aprile 2007, pp. 73–77, PMID 17505412.
^ L Horn, Sandler AB, Putnam JB Jr, Johnson DH, The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer, in Journal of Thoracic Oncology, vol. 2, nº 5, maggio 2007, pp. 377–383, DOI:10.1097/01.JTO.0000268669.64625.bb, PMID 17473651.
^ HA Wakelee, Schiller JH, Gandara DR, Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial, in Clinical Lung Cancer, vol. 8, nº 1, luglio 2006, pp. 18–21, DOI:10.3816/CLC.2006.n.028, PMID 16870041.
^ British Medical Journal, Clinical evidence concise: the international resource of the best available evidence for effective health care, 14ª ed., Londra, BMJ Publishing Group, dicembre 2005, pp. 486–488, ISBN 1-905545-00-2.
^ R Arriagada, Goldstraw P, Le Chevalier T, Oxford Textbook of Oncology, 2ª ed., Oxford University Press, 2002, p. 2094, ISBN 0-19-262926-3.
^ H Wagner, Radiation therapy in the management of limited small cell lung cancer: when, where, and how much? (PDF)
[collegamento interrotto], in Chest, vol. 113, Suppl. 1, gennaio 1998, pp. 92-100S, DOI:10.1378/chest.113.1_Supplement.92S, PMID 9438697.
^ Postoperative radiotherapy for non-small cell lung cancer, in Cochrane database of systematic reviews (Online), nº 2, 2005, pp. CD002142, DOI:10.1002/14651858.CD002142.pub2, PMID 15846628.
^ BE Lally, Zelterman D, Colasanto JM et al., Postoperative Radiotherapy for Stage II or III Non–Small-Cell Lung Cancer Using the Surveillance, Epidemiology, and End Results Database (PDF), in Journal of Clinical Oncology, vol. 24, nº 19, John Wiley & Sons, luglio 2006, pp. 2998–3006, DOI:10.1200/JCO.2005.04.6110, PMID 16769986.
^ A Raben, Mychalczak B, Brachytherapy for non-small cell lung cancer and selected neoplasms of the chest (PDF)
[collegamento interrotto], in Chest, vol. 112, Suppl. 4, ottobre 1997, pp. 276–286S, DOI:10.1378/chest.112.4_Supplement.276S, PMID 9337304.
^ B Celebioglu, Gurkan OU, Erdogan S et al., High dose rate endobronchial brachytherapy effectively palliates symptoms due to inoperable lung cancer (PDF), in Japanese Journal of Clinical Oncology, vol. 32, nº 11, novembre 2002, pp. 443–448, DOI:10.1093/jjco/hyf102, PMID 12499415.
^ M Ng, Chong J, Milner A et al., Tolerability of accelerated chest irradiation and impact on survival of prophylactic cranial irradiation in patients with limited-stage small cell lung cancer: review of a single institution's experience, in Journal of Thoracic Oncology, vol. 2, nº 6, giugno 2007, pp. 506–513, DOI:10.1097/JTO.0b013e318060095b, PMID 17545845.
^ J.E. Graham, C. Jones, A.N. Hughes, Prophylactic cranial irradiation (PCI) in extensive stage small cell lung cancer (ED-SCLC): a retrospective review of practice at the Northern Centre for Cancer Treatment, in Lung cancer, vol. 63, nº 1, gennaio 2009, pp. s12-s13, DOI:10.1016/S0169-5002(09)70038-8.
^ B Slotman, Faivre-Finn C, Kramer G et al., Prophylactic cranial irradiation in extensive small-cell lung cancer, in New England Journal of Medicine, vol. 357, nº 7, agosto 2007, pp. 664–672, DOI:10.1056/NEJMoa071780, PMID 17699816.
^ H Hof, Muenter M, Oetzel D et al., Stereotactic single-dose radiotherapy (radiosurgery) of early stage nonsmall-cell lung cancer (NSCLC), in Cancer, vol. 110, nº 1, luglio 2007, pp. 148–155, DOI:10.1002/cncr.22763, PMID 17516437.
^ CJ Simon, Dupuy DE, DiPetrillo TA, et al., Pulmonary radiofrequency ablation: long-term safety and efficacy in 153 patients (PDF), in Radiology, vol. 243, nº 1, aprile 2007, pp. 268–275, DOI:10.1148/radiol.2431060088, PMID 17392258.
^ MC Ambrogi, Fanucchi O, Cioni R, et al., Long-term results of radiofrequency ablation treatment of stage I non-small cell lung cancer: a prospective intention-to-treat study, in Journal of Thoracic Oncology, vol. 12, nº 6, dicembre 2011, pp. 2044-2051, DOI:10.1097/JTO.0b013e31822d538d.Controllare il valore del parametrodoi(aiuto), PMID 22052222.
^ DJ Raz, He B, Rosell R, Jablons DM, Bronchioloalveolar carcinoma: a review, in Clinical Lung Cancer, vol. 7, nº 5, marzo 2006, pp. 313–322, DOI:10.3816/CLC.2006.n.012, PMID 16640802.
^ ab K Bencardino, Manzoni M, Delfanti S et al., Epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small-cell lung cancer: results and open issues, in Internal and Emergency Medicine, vol. 2, nº 1, marzo 2007, pp. 3–12, DOI:10.1007/s11739-007-0002-5, PMID 17551677.
^ R Feld, Sridhar SS, Shepherd FA et al., Use of the epidermal growth factor receptor inhibitors gefitinib and erlotinib in the treatment of non-small cell lung cancer: a systematic review, in Journal of Thoracic Oncology, vol. 1, nº 4, maggio 2006, pp. 367–376, DOI:10.1097/01243894-200605000-00018, PMID 17409886.
^ A Sandler, Gray R, Perry M et al., Paclitaxel–carboplatin alone or with bevacizumab for non–small cell lung cancer (PDF), in New England Journal of Medicine, vol. 355, nº 24, dicembre 2006, pp. 2542–50, DOI:10.1056/NEJMoa061884, PMID 17167137.
^ MJ Edelman, Novel cytotoxic agents for non-small cell lung cancer, in Journal of Thoracic Oncology, vol. 1, nº 7, settembre 2006, pp. 752–755, PMID 17409954.
^ R Danesi, Pasqualetti G, Giovannetti E, Del Tacca M, The role of pharmacogenetics in adjuvant treatment of non-small cell lung cancer, in Journal of Thoracic Oncology, vol. 2, 5 Suppl., maggio 2007, pp. S27–S30, DOI:10.1097/01.JTO.0000268638.10332.07, PMID 17457227.
^ FH Blackhall, Shepherd FA, Small cell lung cancer and targeted therapies, in Current Opinion in Oncology, vol. 19, nº 2, marzo 2007, pp. 103–108, DOI:10.1097/CCO.0b013e328011bec3, PMID 17272981.
^ JM Lee, Mao JT, Krysan K, Dubinett SM, Significance of cyclooxygenase-2 in prognosis, targeted therapy and chemoprevention of NSCLC, in Future Oncology, vol. 2, nº 2, aprile 2007, pp. 149–153, DOI:10.2217/14796694.3.2.149, PMID 17381414.
^ CM Whitehead, Earle KA, Fetter J et al., Exisulind-induced Apoptosis in a Non-Small Cell Lung Cancer Orthotopic Lung Tumor Model Augments Docetaxel Treatment and Contributes to Increased Survival (PDF), in Molecular Cancer Therapeutics, vol. 2, pp. 479–488, PMID 12748310.
^ G Scagliotti, Proteasome inhibitors in lung cancer, in Critical Reviews in Oncology/Haematology, vol. 58, nº 3, giugno 2006, pp. 177–189, DOI:10.1016/j.critrevonc.2005.12.001, PMID 16427303.
^ KH Dragnev, Petty WJ, Shah SJ et al., A proof-of-principle clinical trial of bexarotene in patients with non-small cell lung cancer (PDF), in Clinical Cancer Research, vol. 13, nº 6, marzo 2007, pp. 1794–1800, DOI:10.1158/1078-0432.CCR-06-1836, PMID 17363535.
^ C Albright, Garst J, Vaccine therapy in non-small cell lung cancer, in Current Oncology Reports, vol. 9, nº 4, luglio 2007, pp. 241–246, DOI:10.1007/s11912-007-0029-9, PMID 17588347.
^ S Sun, Schiller JH, Spinola M, Minna JD, New molecularly targeted therapies for lung cancer, in Journal of Clinical Investigation, vol. 117, nº 10, ottobre 2007, pp. 2740–2750, DOI:10.1172/JCI31809, PMID 17909619.
^ abcd Clifton F. Mountain, Revisions in the International System for Staging Lung Cancer (PDF)
[collegamento interrotto], in Chest, vol. 111, nº 6, giugno 1997, pp. 1710-1717, DOI:10.1378/chest.111.6.1710.
^ William D. Travis, Lois B. Travis, Susan S. Devesa, Lung cancer, in Cancer, vol. 75, s1, settembre 1994, pp. 191-202, DOI:10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y.
^ DC. McCrory, GL. Colice; SZ. Lewis; WM. Alberts; S. Parker, Overview of methodology for lung cancer evidence review and guideline development., in Chest, vol. 123, 1 Suppl, gennaio 2003, pp. 3S-6S, PMID 12527561.
^ P Vineis, Hoek G, Krzyzanowski M et al., Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study (PDF), in Environmental Health, vol. 6, febbraio 2007, p. 7, DOI:10.1186/1476-069X-6-7, PMID 17302981.
^ (EN) National Tobacco Control Program, Centers for Disease Control. URL consultato il 10 gennaio 2012.
^ G Pandey, Bhutan's smokers face public ban, BBC, febbraio 2005. URL consultato il 27 luglio 2009.
^ N Gray, A global approach to tobacco policy, in Lung Cancer, vol. 39, nº 2, febbraio 2003, pp. 113–117, DOI:10.1016/S0169-5002(02)00456-7, PMID 12581561.
^ Slatore CG, Littman AJ, Au DH, Satia JA, White E, Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer (PDF), in American Journal of Respiratory and Critical Care Medicine, vol. 177, nº 5, 2008, pp. 524–30, DOI:10.1164/rccm.200709-1398OC, PMID 17989343.
^ UN health agency calls for total ban on tobacco advertising to protect young, United Nations News service. URL consultato il 27 luglio 2009.
^ Misure di screening in italia (PDF), Ministero della Salute, ottobre 2005. URL consultato il 30 luglio 2009.
^ Humphrey LL, Teutsch S, Johnson M, Lung cancer screening with sputum cytologic examination, chest radiography, and computed tomography: an update for the U.S. Preventive Services Task Force (PDF), in Ann. Intern. Med., vol. 140, nº 9, 4 maggio 2004, pp. 740–53, PMID 15126259.
^ U.S. Preventive Services Task Force, Lung cancer screening: recommendation statement (PDF), in Ann. Intern. Med., vol. 140, nº 9, 2004, pp. 738–9, PMID 15126258.
^ Alberts WM, Diagnosis and Management of Lung Cancer Executive Summary: ACCP Evidence-Based Clinical Practice Guidelines (2nd Edition), in Chest, vol. 132, 3 suppl, 2007, pp. 1S–19S, DOI:10.1378/chest.07-1860, PMID 17873156.
^ Henschke CI, Yankelevitz DF, Libby DM, Pasmantier MW, Smith JP, Miettinen OS, Survival of patients with stage I lung cancer detected on CT screening
[collegamento interrotto], in N. Engl. J. Med., vol. 355, nº 17, 2006, pp. 1763–71, DOI:10.1056/NEJMoa060476, PMID 17065637.
^ Kaneko M, Eguchi K, Ohmatsu H, et al., Peripheral lung cancer: screening and detection with low-dose spiral CT versus radiography (PDF), in Radiology, vol. 201, nº 3, dicembre 1996, pp. 798–802, PMID 8939234.
^ Sone S, Takashima S, Li F, et al., Mass screening for lung cancer with mobile spiral computed tomography scanner, in Lancet, vol. 351, nº 9111, aprile 1998, pp. 1242–5, DOI:10.1016/S0140-6736(97)08229-9, PMID 9643744.
^ Sone S, Li F, Yang ZG, et al., Results of three-year mass screening programme for lung cancer using mobile low-dose spiral computed tomography scanner, in Br. J. Cancer, vol. 84, nº 1, gennaio 2001, p. 25–32, DOI:10.1054/bjoc.2000.1531, PMID 11139308.
^ S
Stephen J. Swensen, MD, James R. Jett, MD, Thomas E. Hartman, MD, David E. Midthun, MD, Sumithra J. Mandrekar, PhD, Shauna L. Hillman, MS, Anne-Marie Sykes, MD, Gregory L. Aughenbaugh, MD, Aaron O. Bungum, BS and Katie L. Allen, BS', CT Screening for Lung Cancer: Five-year Prospective Experience
[collegamento interrotto], in Radiology, vol. 235, 2005, p. 259-265, DOI:10.1148/radiol.2351041662, PMID 15695622.
^ Bach PB, Jett JR, Pastorino U, Tockman MS, Swensen SJ, Begg CB, Computed tomography screening and lung cancer outcomes, in JAMA, vol. 297, nº 9, 2007, pp. 953–61, DOI:10.1001/jama.297.9.953, PMID 17341709.
^ Crestanello JA, Allen MS, Jett J, Cassivi SD, et al., Thoracic surgical operations in patients enrolled in a computed tomographic screening trial, in Journal of Thoracic and Cardiovascular Surgery, vol. 128, nº 2, 2004, p. 254–259, DOI:10.1016/j.jtcvs.2004.02.017, PMID 15282462.
^ Conrad DH, Goyette J, Thomas PS, Proteomics as a method for early detection of cancer: a review of proteomics, exhaled breath condensate, and lung cancer screening, in Journal of General Internal Medicine, vol. 23, Suppl. 1, 2008, pp. 78–84, PMID 18095050.
Bibliografia |
Oncologia |
- DeVita, Hellman, Lawrence, DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology, 8ª ed., Lippincott Williams & Wilkins, 2008, ISBN 978-0-7817-7207-5.
- Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica, 8ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2.
Patogenesi e genetica |
- Pontieri, Russo, Frati, Patologia generale, 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6.
- Giovanni Neri, Maurizio Genuardi, Genetica umana e medica, Milano, Elsevier Masson, 2008, ISBN 978-88-214-2917-0.
Anatomia patologica |
- Robbins e Cotran, Le basi patologiche delle malattie, 7ª ed., Torino-Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7.
- Mariuzzi, Anatomia patologica e correlazioni anatomo-cliniche, Padova, Piccin, 2006, ISBN 978-88-299-1769-3.
- James O'D. McGee, Peter G. Isaacson, Nicholas A. Wright, Heather M. Dick, Mary P. E. Slack, Oxford Textbook of Pathology, New York, Oxford University Press, USA, 2007, ISBN 978-0-19-261972-3.
- V. Colby, Tumors of the lower respiratory tract, 3ª ed., Washington DC, American Registry of Pathology, 1995, ISBN 1-881041-17-4.
Medicina interna |
- Harrison, Principi di Medicina Interna - Il manuale, 16ª ed., New York-Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3.
- Claudio Rugarli, Medicina interna sistematica, 5ª ed., Masson, 2005, ISBN 978-88-214-2792-3.
Diagnostica per immagini e radioterapia |
- Fraser, Colman, Müller, Paré, Malattie del torace. Diagnostica per immagini e valutazione clinica, 3ª ed., Milano, Elsevier Masson, 2006, ISBN 88-85675-87-5.
- Giorgio Cittadini, Diagnostica per immagini e radioterapia, ECIG, 2008, ISBN 978-88-7544-138-8.
- Angelelli, AA.VV., Diagnostica per immagini per studenti e medici di medicina generale, Napoli, Idelson-Gnocchi, 2008, ISBN 978-88-7947-489-4.
Chirurgia |
- Patterson, Cooper, Deslauriers, Griffith Pearson, Luketich, Pearson's Thoracic and Esophageal Surgery, 3ª ed., Elsevier, 2008, ISBN 978-0-443-06861-4.
- Alberto Oliaro, Manuale di malattie dell'apparato respiratorio. Chirurgia toracica, pneumologia, Minerva medica, 2007, ISBN 978-88-7711-547-8.
- Dionigi, Basi teoriche e Chirurgia generale - Chirurgia specialistica, 4ª ed., Padova, Elsevier Masson, 2006, ISBN 978-88-299-1654-2.
- Mazzeo - Forestieri, Trattato di chirurgia oncologica, PICCIN - Nuova libreria, 2006, ISBN 88-214-2912-1.
Terapia farmacologica, Chemioterapia |
- Brunton, Lazo, Parker, Goodman & Gilman - Le basi farmacologiche della terapia, 11ª ed., McGraw Hill, 2006, ISBN 978-88-386-3911-1.
- Bertram G. Katzung, Farmacologia generale e clinica, Padova, Piccin, 2006, ISBN 88-299-1804-0.
- MC. Ambrogi, M. Lucchi; P. Dini; F. Melfi; G. Fontanini; P. Faviana; O. Fanucchi; A. Mussi, Percutaneous radiofrequency ablation of lung tumours: results in the mid-term., in Eur J Cardiothorac Surg, vol. 30, nº 1, luglio 2006, pp. 177-83, DOI:10.1016/j.ejcts.2006.03.067, PMID 16723242.
Voci correlate |
- Neoplasia
- Apparato respiratorio
- Polmone
- Tabagismo
- Amianto
- Classificazione TNM
- Metastasi
- Stadio tumorale
- Lega polmonare svizzera
- Nodulo polmonare solitario
Altri progetti |
Altri progetti
- Wikiquote
- Wikimedia Commons
 Wikiquote contiene citazioni sul carcinoma del polmone
Wikiquote contiene citazioni sul carcinoma del polmone
 Wikimedia Commons contiene immagini o altri file sul carcinoma del polmone
Wikimedia Commons contiene immagini o altri file sul carcinoma del polmone
Collegamenti esterni |
- AIRC – Guida Tumori - Tumore al polmone, su airc.it.
Immagini di tumore al polmone - CT Cases.net- ALCASE Italia – La Guida al carcinoma del polmone, su alcase.it.
- (EN) WHO - Tumore al polmone, su search.who.int.
- (EN) www.cancer.gov - Tumore al polmone, su cancer.gov.
- (EN) www.cdc.gov - Tumore al polmone, su cdc.gov.
Classificazione e risorse esterne (EN) |
ICD-9-CM: 162.3, 162.5, 162.8 e 162.4; ICD-10-CM: C34.2, C34.1 e C34.3; OMIM: 211980, 608935, 612593, 614210 e 612571; MeSH: D008175; DiseasesDB: 7616; MedlinePlus: 007194;eMedicine: 279960, 280104, 362919, 358274 e 358433;NCI: NCI ID; |
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | LCCN (EN) sh85078900 · GND (DE) 4008343-3 |
|---|
0LRDjhpzQEEotAUfGkA 7GEFngM29eDUHR4 84RlwL2nQDUKPxI

























