Озон

Multi tool use
| Озон | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Трикислород |
| Хим. формула | O3 |
| Физические свойства | |
| Состояние | голубой газ |
| Молярная масса | 47,998 г/моль |
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К)[1] |
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м |
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] |
| Энергия ионизации | 12,52 ± 0,01 эВ[3] |
| Термические свойства | |
| Т. плав. | −197,2 °C |
| Т. кип. | −111,9 °C |
| Кр. темп. | −12,0 °С (261,1 К)[1] °C |
| Кр. давл. | 54,6 атм.[1] |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) |
| Энтальпия образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль |
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К)[1] |
| Давление пара | 1 ± 1 атм[3] |
| Химические свойства | |
Растворимость в воде |
1,06 г/л (при 0 °С)[2] |
| Диэлектр. прониц. | 1,0019 (г), 4,79 (ж)[1] |
| Оптические свойства | |
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм)[1] |
| Структура | |
| Дипольный момент | 0,5337 Д |
| Классификация | |
| Рег. номер CAS | 10028-15-6 |
| PubChem | 24823 |
| Рег. номер EINECS | 233-069-2 |
| SMILES | [O-][O+]=O |
| InChI | 1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N |
| RTECS | RS8225000 |
| ChEBI | 25812 |
| ChemSpider | 23208 |
| Безопасность | |
| ЛД50 |
4,8 ppm |
| Токсичность | сильнодействующий яд, обладающий раздражающим, канцерогенным и мутагенным действием  |
| Пиктограммы СГС |     |
| NFPA 704 |  0 4 4 OX |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Содержание
1 Строение озона
2 История открытия
3 Физические свойства
4 Химические свойства
5 Получение озона
6 Биологические свойства
7 Применение озона
7.1 Применение жидкого озона
8 Озон в атмосфере
9 См. также
10 Примечания
11 Литература
12 Ссылки
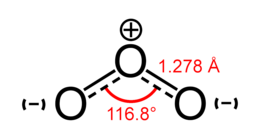
Строение озона |
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[4]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[5].
История открытия |
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[6]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[6]:
- O3+H2O+2KI→O2+2KOH+I2{displaystyle {mathsf {O_{3}+H_{2}O+2KIrightarrow O_{2}+2KOH+I_{2}}}}
- O3+H2O+2KI→O2+2KOH+I2{displaystyle {mathsf {O_{3}+H_{2}O+2KIrightarrow O_{2}+2KOH+I_{2}}}}
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[7].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[6].
Физические свойства |
Молекулярная масса — 48 а.е.м.
Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[8]).- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3[1].
Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[9]. По другим сведениям[1]Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
Критическая температура −12,0 °С (261,1 К)[1].
Критическое давление 51,6 атм[1].
Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с[1].
Теплота плавления 2,1 кДж/моль[1].
Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
Потенциал ионизации молекулы 12,52 эВ[1].- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства |
Образование озона проходит по обратимой реакции:
- 3O2+68kcal/mol(285kJ/mol)→2O3{displaystyle {mathsf {3O_{2}+68kcal/mol(285kJ/mol)rightarrow 2O_{3}}}}
- 3O2+68kcal/mol(285kJ/mol)→2O3{displaystyle {mathsf {3O_{2}+68kcal/mol(285kJ/mol)rightarrow 2O_{3}}}}
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[10] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[11] и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
- 2Cu2++2H3O++O3→2Cu3++3H2O+O2{displaystyle {mathsf {2Cu^{2+}+2H_{3}O^{+}+O_{3}rightarrow 2Cu^{3+}+3H_{2}O+O_{2}}}}
- 2Cu2++2H3O++O3→2Cu3++3H2O+O2{displaystyle {mathsf {2Cu^{2+}+2H_{3}O^{+}+O_{3}rightarrow 2Cu^{3+}+3H_{2}O+O_{2}}}}
Озон повышает степень окисления оксидов:
- NO+O3→NO2+O2{displaystyle {mathsf {NO+O_{3}rightarrow NO_{2}+O_{2}}}}
- NO+O3→NO2+O2{displaystyle {mathsf {NO+O_{3}rightarrow NO_{2}+O_{2}}}}
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
- 2NO2+O3→N2O5+O2{displaystyle {mathsf {2NO_{2}+O_{3}rightarrow N_{2}O_{5}+O_{2}}}}
- 2NO2+O3→N2O5+O2{displaystyle {mathsf {2NO_{2}+O_{3}rightarrow N_{2}O_{5}+O_{2}}}}
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
- N2+O3→N2O+O2{displaystyle {mathsf {N_{2}+O_{3}rightarrow N_{2}O+O_{2}}}}
- N2+O3→N2O+O2{displaystyle {mathsf {N_{2}+O_{3}rightarrow N_{2}O+O_{2}}}}
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
- 2C+2O3→2CO2+O2{displaystyle {mathsf {2C+2O_{3}rightarrow 2CO_{2}+O_{2}}}}
- 2C+2O3→2CO2+O2{displaystyle {mathsf {2C+2O_{3}rightarrow 2CO_{2}+O_{2}}}}
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
- 2NH3+4O3→NH4NO3+4O2+H2O{displaystyle {mathsf {2NH_{3}+4O_{3}rightarrow NH_{4}NO_{3}+4O_{2}+H_{2}O}}}
- 2NH3+4O3→NH4NO3+4O2+H2O{displaystyle {mathsf {2NH_{3}+4O_{3}rightarrow NH_{4}NO_{3}+4O_{2}+H_{2}O}}}
Озон реагирует с водородом с образованием воды и кислорода:
- O3+H2→O2+H2O{displaystyle {mathsf {O_{3}+H_{2}rightarrow O_{2}+H_{2}O}}}
- O3+H2→O2+H2O{displaystyle {mathsf {O_{3}+H_{2}rightarrow O_{2}+H_{2}O}}}
Озон реагирует с сульфидами с образованием сульфатов:
- PbS+4O3→PbSO4+4O2{displaystyle {mathsf {PbS+4O_{3}rightarrow PbSO_{4}+4O_{2}}}}
- PbS+4O3→PbSO4+4O2{displaystyle {mathsf {PbS+4O_{3}rightarrow PbSO_{4}+4O_{2}}}}
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
- S+H2O+O3→H2SO4{displaystyle {mathsf {S+H_{2}O+O_{3}rightarrow H_{2}SO_{4}}}}
- 3SO2+3H2O+O3→3H2SO4{displaystyle {mathsf {3SO_{2}+3H_{2}O+O_{3}rightarrow 3H_{2}SO_{4}}}}
- S+H2O+O3→H2SO4{displaystyle {mathsf {S+H_{2}O+O_{3}rightarrow H_{2}SO_{4}}}}
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
- H2S+O3→SO2+H2O{displaystyle {mathsf {H_{2}S+O_{3}rightarrow SO_{2}+H_{2}O}}}
- H2S+O3→SO2+H2O{displaystyle {mathsf {H_{2}S+O_{3}rightarrow SO_{2}+H_{2}O}}}
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
- H2S+O3→S+O2+H2O{displaystyle {mathsf {H_{2}S+O_{3}rightarrow S+O_{2}+H_{2}O}}}
- H2S+O3→S+O2+H2O{displaystyle {mathsf {H_{2}S+O_{3}rightarrow S+O_{2}+H_{2}O}}}
- 3H2S+4O3→3H2SO4{displaystyle {mathsf {3H_{2}S+4O_{3}rightarrow 3H_{2}SO_{4}}}}
- 3H2S+4O3→3H2SO4{displaystyle {mathsf {3H_{2}S+4O_{3}rightarrow 3H_{2}SO_{4}}}}
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
- 3SnCl2+6HCl+O3→3SnCl4+3H2O{displaystyle {mathsf {3SnCl_{2}+6HCl+O_{3}rightarrow 3SnCl_{4}+3H_{2}O}}}
- 3SnCl2+6HCl+O3→3SnCl4+3H2O{displaystyle {mathsf {3SnCl_{2}+6HCl+O_{3}rightarrow 3SnCl_{4}+3H_{2}O}}}
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
- I2+6HClO4+O3→2I(ClO4)3+3H2O{displaystyle {mathsf {I_{2}+6HClO_{4}+O_{3}rightarrow 2I(ClO_{4})_{3}+3H_{2}O}}}
- I2+6HClO4+O3→2I(ClO4)3+3H2O{displaystyle {mathsf {I_{2}+6HClO_{4}+O_{3}rightarrow 2I(ClO_{4})_{3}+3H_{2}O}}}
Твёрдый перхлорат нитрония может быть получен реакцией газообразных NO2, ClO2 и O3:
- 2NO2+2ClO2+2O3→2NO2ClO4+O2{displaystyle {mathsf {2NO_{2}+2ClO_{2}+2O_{3}rightarrow 2NO_{2}ClO_{4}+O_{2}}}}
- 2NO2+2ClO2+2O3→2NO2ClO4+O2{displaystyle {mathsf {2NO_{2}+2ClO_{2}+2O_{3}rightarrow 2NO_{2}ClO_{4}+O_{2}}}}
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
- 3C4N2+4O3→12CO+3N2{displaystyle {mathsf {3C_{4}N_{2}+4O_{3}rightarrow 12CO+3N_{2}}}}
- 3C4N2+4O3→12CO+3N2{displaystyle {mathsf {3C_{4}N_{2}+4O_{3}rightarrow 12CO+3N_{2}}}}
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
- H+O3→HO2⋅+O{displaystyle {mathsf {H+O_{3}rightarrow HO_{2}cdot +O}}}
- H+O3→HO2⋅+O{displaystyle {mathsf {H+O_{3}rightarrow HO_{2}cdot +O}}}
- 2HO2⋅→H2O2+O2{displaystyle {mathsf {2HO_{2}cdot rightarrow H_{2}O_{2}+O_{2}}}}
- 2HO2⋅→H2O2+O2{displaystyle {mathsf {2HO_{2}cdot rightarrow H_{2}O_{2}+O_{2}}}}
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
- KO2+O3→KO3+O2{displaystyle {mathsf {KO_{2}+O_{3}rightarrow KO_{3}+O_{2}}}}
- KO2+O3→KO3+O2{displaystyle {mathsf {KO_{2}+O_{3}rightarrow KO_{3}+O_{2}}}}
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
- 2KOH+5O3→2KO3+5O2+H2O{displaystyle {mathsf {2KOH+5O_{3}rightarrow 2KO_{3}+5O_{2}+H_{2}O}}}
- 2KOH+5O3→2KO3+5O2+H2O{displaystyle {mathsf {2KOH+5O_{3}rightarrow 2KO_{3}+5O_{2}+H_{2}O}}}
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
- CsO3+Na+→Cs++NaO3{displaystyle {mathsf {CsO_{3}+Na^{+}rightarrow Cs^{+}+NaO_{3}}}}
- CsO3+Na+→Cs++NaO3{displaystyle {mathsf {CsO_{3}+Na^{+}rightarrow Cs^{+}+NaO_{3}}}}
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
- 3Ca+10NH3+7O3→Ca⋅6NH3+Ca(OH)2+Ca(NO3)2+2NH4O3+3O2+2H2O{displaystyle {mathsf {3Ca+10NH_{3}+7O_{3}rightarrow Cacdot 6NH_{3}+Ca(OH)_{2}+Ca(NO_{3})_{2}+2NH_{4}O_{3}+3O_{2}+2H_{2}O}}}
- 3Ca+10NH3+7O3→Ca⋅6NH3+Ca(OH)2+Ca(NO3)2+2NH4O3+3O2+2H2O{displaystyle {mathsf {3Ca+10NH_{3}+7O_{3}rightarrow Cacdot 6NH_{3}+Ca(OH)_{2}+Ca(NO_{3})_{2}+2NH_{4}O_{3}+3O_{2}+2H_{2}O}}}
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
- 2Fe2++O3+5H2O→2Fe(OH)3↓+O2+4H+{displaystyle {mathsf {2Fe^{2+}+O_{3}+5H_{2}Orightarrow 2Fe(OH)_{3}downarrow +O_{2}+4H^{+}}}}
- 2Mn2++2O3+4H2O→2MnO(OH)2↓+2O2+4H+{displaystyle {mathsf {2Mn^{2+}+2O_{3}+4H_{2}Orightarrow 2MnO(OH)_{2}downarrow +2O_{2}+4H^{+}}}}
- 2Fe2++O3+5H2O→2Fe(OH)3↓+O2+4H+{displaystyle {mathsf {2Fe^{2+}+O_{3}+5H_{2}Orightarrow 2Fe(OH)_{3}downarrow +O_{2}+4H^{+}}}}
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
- CN−+O3→CNO−+O2{displaystyle {mathsf {CN^{-}+O_{3}rightarrow CNO^{-}+O_{2}}}}
- CN−+O3→CNO−+O2{displaystyle {mathsf {CN^{-}+O_{3}rightarrow CNO^{-}+O_{2}}}}
Озон может полностью разлагать мочевину[15] :
- (NH2)2CO+O3→N2+CO2+2H2O{displaystyle {mathsf {(NH_{2})_{2}CO+O_{3}rightarrow N_{2}+CO_{2}+2H_{2}O}}}
- (NH2)2CO+O3→N2+CO2+2H2O{displaystyle {mathsf {(NH_{2})_{2}CO+O_{3}rightarrow N_{2}+CO_{2}+2H_{2}O}}}
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Получение озона |
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[7]:
- 3H2SO4+3BaO2→3BaSO4+O3+3H2O{displaystyle {mathsf {3H_{2}SO_{4}+3BaO_{2}rightarrow 3BaSO_{4}+O_{3}+3H_{2}O}}}
- 3H2SO4+3BaO2→3BaSO4+O3+3H2O{displaystyle {mathsf {3H_{2}SO_{4}+3BaO_{2}rightarrow 3BaSO_{4}+O_{3}+3H_{2}O}}}
Биологические свойства |
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным и мутагенным, а также может приводить к преждевременной смерти[16].
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[17];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[17];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) - 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³[18].
Озон эффективно убивает плесень и бактерии.
Применение озона |
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[18] токсинов в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[19].
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники[источник не указан 2485 дней].
Применение жидкого озона |
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[20]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными[21]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры и для повышения УИ осталось возможным перейти на новые виды топлива.
Озон в атмосфере |
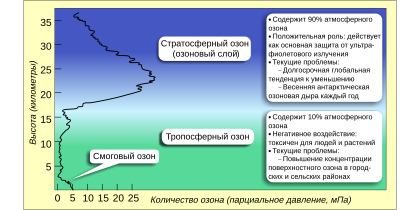
Распределение озона по высоте
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
См. также |
- Ионизирующее излучение
Примечания |
↑ 12345678910111213141516171819202122 Лунин, 1998.
↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91–100. Auflage. de Gruyter, 1985, S. 460.
↑ 12 http://www.cdc.gov/niosh/npg/npgd0476.html
↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278—5283.
↑ 123 С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
↑ 12 Получение озона и его определение — видеоопыт в Единой коллекции цифровых образовательных ресурсов
↑
Справочник химика, т. II. Л., «Химия», 1971.
↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974.
↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion? Архивировано 1 июня 2006 года.
↑ Платина не окисляется озоном, но катализирует его разложение.
↑ 12 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
↑ National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
↑ 12 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Гигиенические нормативы 2.1.6.1338-03 (неопр.) (недоступная ссылка). Проверено 21 ноября 2012. Архивировано 3 декабря 2013 года.
↑ 12 Озон — мирное оружие XXI века — Костромской научно-исследовательский институт сельского хозяйства
↑ Questionable methods of cancer management: hydrogen peroxide and other 'hyperoxygenation' therapies Архивная копия от 7 июля 2010 на Wayback Machine, American Cancer Society
↑ Перспективные окислители. (неопр.) (недоступная ссылка). Проверено 24 декабря 2009. Архивировано 3 ноября 2009 года.
↑ The Dynamics of Unsteady Detonation in Ozone
Литература |
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
Ссылки |
Озон — Химическая энциклопедия.- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.
2F d7Ro90zZrsx,t1kU 2pezLxu4nm

































